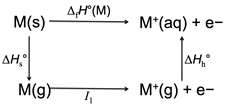鋰離子標準還原電位異常的探討/施建輝
鋰離子標準還原電位異常的探討
施建輝
國立新竹科學園區實驗高級中學
教育部高中化學學科中心
n為何鋰離子的標準還原電位值最負?
問:在標準還原電位表中,鋰離子的標準還原電位最負,亦即鋰金屬的標準氧化電位最正,但常見的鹼金屬活性的順序為K > Na > Li,如何解釋此一現象?
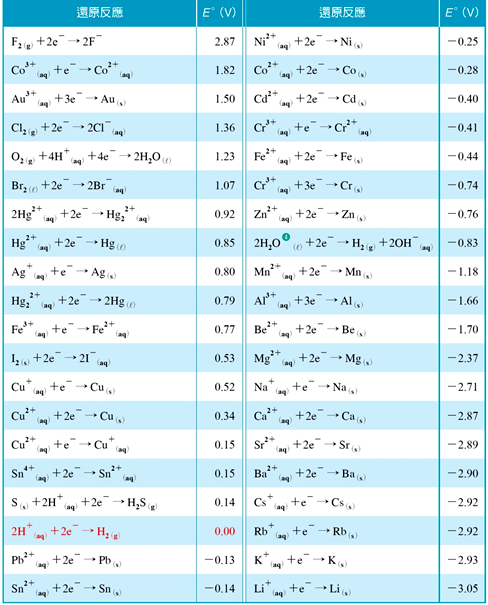
常見的標準還原電位表如表1所示,其中Na, K, Li的標準還原電位分別為 2.71 V, 2.93 V, 3.05 V。
表1:標準還原電位表(取自翰林選修化學上冊)
n解答一:以水合能大小說明
n解答二:以能量變化說明
在無機元素化學(科學出版社)一書中,有精闢的說明,整理如下,供各位參考:
鹼金屬在水中形成水合離子的能量變化(圖1)
圖1:鹼金屬在水中形成水合離子的能量變化
Hs°為氣態金屬離子的水合能,I1為鹼金屬的第一游離能。
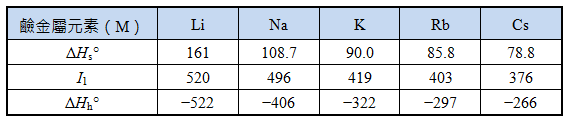
鹼金屬元素的熱力學數據(表2)
表2:鹼金屬元素的熱力學數據(單位:kJ mol-1)
計算鹼金屬失去電子形成水合離子所需能量:
522 kJ mol-1)=159 kJ mol-1
406 kJ mol-1)=199 kJ mol-1
由於Li變成Li+(aq)的過程所需總能量較小,因此鋰比鈉容易失去電子形成水合離子,故在水中,鋰是鹼金屬中最強的還原劑。
金屬標準還原電位的計算:以Li與Na為例
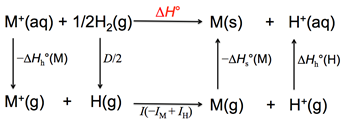
為了獲得金屬標準還原電位,設計M+(aq)得到電子的反應,如圖2所示。
圖2:金屬標準還原電位的計算過程示意圖
Hh°(M)Hs°為金屬的昇華熱。
1090 kJ mol-1。
159 kJ mol-1
199 kJ mol-1
1090 kJ mol-1) = 438 kJ mol-1
159 kJ mol-1) + 438 kJ mol-1 = 279 kJ mol-1
199 kJ mol-1) + 438 kJ mol-1 = 239 kJ mol-1
從熱力學函數表中可以查出
73.8 J mol-1 k-1。
G°( = ΔH° ,如下:
50.3/1000) kJ mol-1 = 294 kJ mol-1
73.8/1000) kJ mol-1 = 261 kJ mol-1
G °= :
3.05 V
= E°(Li+/Li)
3.05V
同理,
2.72V
n參考資料
無機元素化學(第二版),科學出版社。