疑難問題集錦之二:基礎科學教學研習會的幾個疑難問題 / 施建輝
疑難問題集錦之二:
基礎科學教學研習會的幾個疑難問題
施建輝
國立新竹科學園區實驗高級中學
教育部高中化學學科中心
[email protected]
自2003年思源科技教育基金會主辦第一屆高中數學暨自然科學教學研習會,到2014年改由交通大學校友會主辦的高中自然科學教學研習會,迄今已舉辦14屆,此一研習會廣受高中職自然科教師的歡迎。研習會上午主要內容是「專題講座」,下午則是分科研習。分科研習分成兩時段,第一時段為「教案觀摩」或「創意實驗分享與實作」,第二時段為「教學疑難問題的Q&A」。第一時段的「教案觀摩」或「創意實驗分享與實作」,邀請研發教師帶領參與教師們分享其教學經驗或研發的實驗,以增進教師的教學知能。第二時段的「教學疑難問題的Q&A」則是由參加研習的教師們事先提出教學上的疑難問題,再由主持分科研習的教師邀請資深教師答覆。本專欄名稱為「高中化學教學疑難問題與解題」,本人負責此專欄,常常負責回答教師疑難問題的「資深」化學教師之一,本人也邀請過其他資深教師撰寫有關回答教學疑難問題。在這篇文章中,本人將重新回答曾經回答過但答覆內容仍有一些疑慮的幾個問題,並在此篇文章中提出本人個人的看法。本人的看法可能會與之前答覆問題的教師見解有所不同,不過本人認為正確的答覆才是最重要的。借用龍應台女士所著的書:「請用文明來說服本人」,本人的見解若是有誤謬之處,本人也希望有教師指正,「請用真理來說服本人」,讓包括本人和其他存有疑慮的教師們解惑。此篇文章要提出的疑難問題如下:
一、 鑽石是否具有導電性?
二、 氫氧化銨(NH4OH)是否存在?
三、 臭氧(O3)變成氧氣(O2)是否為氧化還原反應?
n 疑難問題一:鑽石是否具有導電性?
在某一次教師研習會上,一位資深的化學教師提出一個觀點:「不要以為鑽石是絕緣體,不導電」,這位教師給了一些物質的導電度的數據(見表1),表1下方1~3為數據說明(此處僅列出其提供的部分資料)。從表一的資料來看,導電率相對比值,石墨:鑽石:食鹽水=16000:4000:1,所以這位教師強調「石墨是導體沒有問題,但是鑽石的導電性比1 M的食鹽水好,怎可將鑽石說成絕緣體!」,看起來似乎言之有理。
表1:三種物質的導電率比較-I
|
物質 |
石墨 |
鑽石 |
1 M食鹽水 |
|
導電率(mho/cm) |
1.3×103 |
2.9×102 |
0.08 |
|
相對比(概略值) |
16000 |
4000 |
1 |
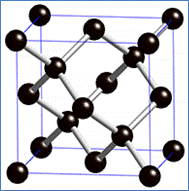
然而,本人對鑽石具有導電性的說法是頗有疑惑的。本人先來看看石墨的結構,如圖1左所示,每個碳原子與鄰近的三個碳原子以共價鍵結合,剩餘的1個價電子,則與另一個碳原子的1個價電子形成π鍵,這2個π電子是未定域化的(delocalized),也就是說這些未定域化的π電子在石墨的每一個層面上是可以移動的,這就是石墨能導電的原因。接著看鑽石的結構,如圖1右所示,每個碳原子與鄰近的四個碳原子以共價鍵結合,形成立體結構,由於要破壞碳碳之間的共價鍵甚難,因此鑽石是目前所知物質中硬度最大的。由於每個碳原子的4個價電子都已與另外四個碳原子形成共價鍵,已經不再有未定域化的電子,因此本人認為鑽石不可能具有導電性,或直接說,本人認為鑽石應該視為絕緣體。
圖1:石墨(左)與鑽石(右)的結構式
(圖片來源:http://goo.gl/rYKlcA(左),http://goo.gl/0w9cNx(右))
為了支持這種說法,本人收集了各種資料,並製作與該位教師提供的類似表格(見表2)。
表2:三種物質的導電率比較-II
|
物質 |
石墨[1] |
鑽石[2] |
1 M食鹽水 |
|
導電率(mho/cm) |
2.0 × 103 ~ 3.0 × 103 |
10−13 ~ 10−16 |
0.08 |
|
相對比(概略值) |
25000 ~ 37500 |
1.25 × 10−12 ~ 1.25 × 10−15 |
1 |
本人查到的資料中,石墨和表1相去不遠,但是鑽石就出現極大的差異。在表1中,導電率相對比值,鑽石:食鹽水=4000:1,但在表2中,導電率相對比值則為鑽石:食鹽水=(1.25×10−12~1.25×10−15):1,比起1 M的食鹽水,鑽石的導電率低了十幾個數量級,依此結果,鑽石絕稱不上是導體,謂之為絕緣體亦不為過。
n 疑難問題二:氫氧化銨是否存在?
早期的化學課本對氨水呈鹼性的描述,都是說氨氣(NH3)溶於水(H2O)生成氫氧化銨(NH4OH),氫氧化銨再解離成銨根(NH4+)與氫氧根(OH−),其化學反應如式[1]和[1]所示:
NH3(g) + H2O(l) → NH4OH(aq) [1]
NH4OH(aq) ⇌ NH4+(aq) + OH−(aq) [2]
後來的化學課本不再出現氫氧化銨(NH4OH)這個名稱,也不再出現NH4OH這個化學式,但是仍有教師習慣在教到氨水時,向學生說出早期的敘述方式。在研習會上就有教師提問:「氫氧化銨是否存在?」這個疑問,也有教師支持這個早期的說法。相同地,本人還是存在疑慮,希望能釐清「氫氧化銨是否存在?」這個疑問。
本人查閱多本化學書籍,列舉各種說法,如下所述:
1. 諾貝爾化學獎得主鮑林(Linus Pauling)在其撰寫的General Chemistry[3] 中提到以氫氧化銨(NH4OH)來說明氨水是弱鹼。
2. 中國大陸普通高等教育〝十一五〞國家級教材之《無機元素化學》[4] 的敘述如下:「NH3為極性分子,在水中溶解度極大,NH3在水中形成NH4+和OH−,使呈鹼性(Kb = 1.75×10−5)。」、「銨鹽和鹼金屬鹽(NH4+與M+),它們陽離子電荷相同,半徑相近(rNH4+ = 148 pm,rK+ = 133 pm,rRb+ = 148 pm),在性質上有許多相似之處(如晶體結構、溶解度)。」
3. 中國大陸《高中理科學習解疑叢書之化學學習解疑》[5]一書,則有一個單元是「為什麼氨水的主要成份可表示為NH3‧H2O,而不能寫成NH4OH?」。主要論點有二,
(1) 「人們還從來沒有檢測到這種弱電解質在水溶液中存在」;
(2) 「大量實驗證明NH4+的性質極像K+,人們無法解釋KOH是一強鹼,而NH4OH卻是一種弱鹼」。
4. Inorganic Chemistry[6] (Nils Wiberg etc.): “Undissociated (NH4)OH does not exist; it is a strong base and exists only in the completely dissociated state. Ammonia, which is almost completely undissociated in aqueous solution, is present as a hydrate (NH3‧nH2O).”
根據以上資料,本人比較認同2~4項這三個論點。鮑林的描述是一種早期的表示法,與本文前面呈現之化學反應式[1]和[2]相同。然而,2~3項這二個論點的資料表示,銨根(NH4+)所帶電荷與陽離子半徑皆與銣離子(Rb+)相近,氫氧化銣(RbOH)是強鹼,在水中幾乎百分之百解離,若氫氧化銨(NH4OH)真的存在,那它也應該是幾乎百分之百解離且呈現強鹼的特性,這與氨水是弱鹼的事實不符。再從另一個觀點來看,因為氫氧化銨(NH4OH)在水中是百分之百解離,所以在水中存在的是銨根(NH4+)與氫氧根(OH−)。若想分離出氫氧化銨(NH4OH)這個化合物,必須加熱趕走水,但是加熱時,氨氣(NH3)將從水中逸出,也就不再存在氫氧化銨(NH4OH),結果是氫氧化銨(NH4OH)無法在水中偵測到其存在的證據,也無法單獨分離出此化合物,所以無法支持氨氣(NH3)溶於水(H2O)生成氫氧化銨(NH4OH)的說法。Nils Wiberg等人撰寫的Inorganic Chemistry告訴我們未解離的氨(NH3)在水中是以水合物NH3‧nH2O存在。根據以上敘述,本人建議教師們捨棄氨氣(NH3)溶於水(H2O)生成氫氧化銨(NH4OH),氫氧化銨(NH4OH)再部分解離生成銨根(NH4+)與氫氧根(OH−)的說法。對於氨水解離,建議使用目前教科書常見的表示法,如式[3]所示:
NH3(g) + H2O(l) ⇌ NH4+(aq) + OH−(aq) [3]
中國大陸的化學書籍則是以式[3]表示,供教師們參考。
NH3‧H2O (aq) ⇌ NH4+(aq) + OH−(aq) [4]
n 疑難問題三:臭氧(O3)變成氧(O2)是否為氧化還原反應?
2016年教師研習會上,有一位化學教師提了一個問題:「臭氧(O3)變成氧氣(O2)是否屬於氧化還原反應」,之前正好另一位教師也問過本人相同的問題,本人就當場為這位教師提供本人的看法。有兩位教師問同樣的問題,顯然它是一個值得重視的問題,本文將提供本人的見解。
若問題「臭氧變成氧氣」指的是2O3 → 3O2,答案很明顯,並沒有任何原子的氧化數發生變化,這個反應不屬於氧化還原反應。為了慎重起見,本人查了化學手冊與電化學等幾本書,在標準還原電位表中呈現的資料都是O3 + 2H+ + 2e− → O2 + H2O E0 = 2.075 V,乍看之下,「似乎」是臭氧(O3)反應生成氧氣(O2)的半反應,但是若能冷靜思考一下,會發現臭氧(O3)與氧氣(O2)兩者並沒有發生氧化數的變化,應該關注的是臭氧(O3)反應生成的水分子(H2O)才是此還原半反應的主要產物,本人試著將這個半反應分段表達其反應,如式[5]~[7]所示:
O3 + 2e− → O2 + O2− [5]
O2− + 2H+ → H2O [6]
[5] + [6] 得 O3 + 2H+ + 2e− → O2 + H2O [7]
若將還原半反應改寫為:O3 + 2H+ + 2e−→ O2 + H2O E0 = 2.075V,就能釐清反應的對象了。因此,問題出在不該將這個半反應解讀為「臭氧變成氧氣」。若是因為參考書出這樣的一個問題:以下何者為氧化還原反應?選項中有「臭氧變成氧氣」,標準答案又列為正確答案,那就難怪造成某些教師的困惑了。
n 參考資料
1. Electrical resistivity and conductivity, https://en.wikipedia.org/wiki/Electrical_resistivity_and_conductivity.
2. J.V. Manca*, M. Nesladek, M. Neelen, C. Quaeyhaegens, L. De Schepper, W. De Ceuninck. High electrical resistivity of CVD-diamond. Microelectronics Reliability, 39, 1999, 269~273.
3. Linus Pauling, General Chemistry, Reprint. Originally published: 3rd Edition, M. H. Freeman, 1970.
4. 劉新錦、朱亞先、高飛編著,無機元素化學(第二版,2010),科學出版社。
5. 朱文祥、龐淑玲、杜宏功編,高中理科學習解疑叢書之化學學習解疑,學術期刊出版社。
6. Nils Wiberg, A. F. Holleman, and Egon Wiberg, Inorganic Chemistry, 34th Edition, Walter de Gruyter, Berlin, New York, 1995.