膠體溶液的帶電性與凝聚/施建輝
膠體溶液的帶電性與凝聚
施建輝
國立新竹科學園區實驗高級中學
教育部高中化學學科中心
[email protected]
n疑難問題
在膠體溶液的單元中,有一段文字敘述:「金屬的氫氧化物帶正電,金屬的硫化物則帶負電」,為何兩者會帶電?為何帶有不同的電荷?
n解答一:膠體溶液的帶電性說明
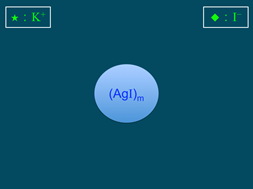
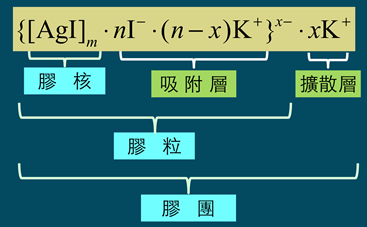
以硝酸銀(AgNO3)溶液與碘化鉀(KI)溶液混合為例,使其中某一溶液過量,過量之電解質溶液扮演穩定劑的角色,讓膠體溶液能穩定存在。碘化銀溶膠的帶電性說明如下。
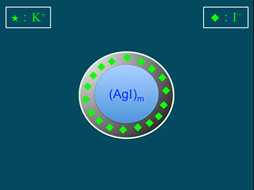
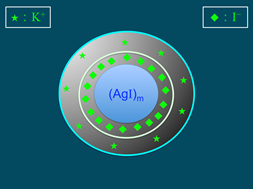
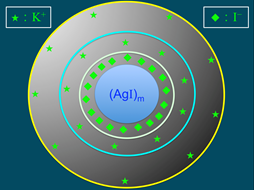
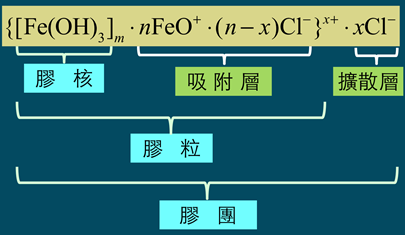
)數目大於鉀離子(K+),故此膠體粒子帶負電。帶負電的膠體粒子再以疏鬆的方式吸引鉀離子(K+),此為擴散層(diffuse layer),膠體粒子與擴散層構成「膠團」(圖4)。膠團即膠體溶液常被提及的「電雙層」(electric double layer),電雙層為電中性。AgI膠團的示意圖,如圖5所示。
課本提及的帶電性即為膠核與吸附層構成的膠體粒子所帶的電荷,上例因碘化鉀溶液過量,故此一膠體溶液帶負電;反之,若是硝酸銀溶液過量,則形成之膠體溶液帶正電。
|
圖1:膠核的形成 |
圖2:膠核吸附碘離子 |
|
圖3:再吸附鉀離子,構成膠體粒子 |
圖4:電雙層的形成 |
圖5:AgI膠團形成的示意圖
回頭說明為何「膠體溶液中,金屬的氫氧化物帶正電,金屬的硫化物帶負電」。
氫氧化鐵溶膠:氯化鐵溶於水可製得氫氧化鐵溶膠,其化學反應式,如[1]~[4]所示:
其中鐵離子(Fe3+)是酸性陽離子,在水中會起水解,其水解過程如下:
[3]
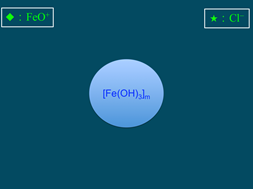
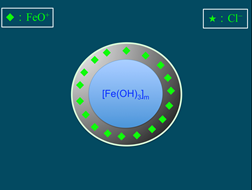
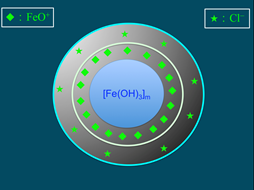
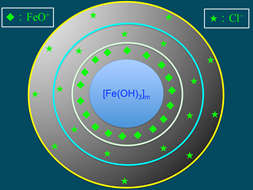
6),膠核選擇性的吸附溶液中類似晶格粒子的而帶正電(圖7)。帶正電的粒子吸引溶液中帶負電荷的氯離子(Cl)(圖8),膠核與吸附層構成「膠體粒子」。因為膠體粒子吸附的數目大於Cl,故此膠體粒子帶正電。帶正電的膠體粒子再以疏鬆的方式吸引Cl,構成「膠團」(圖9)。膠團的示意圖,如圖10所示。
|
圖6:膠核的形成 |
圖7:膠核吸附FeO+離子 |
|
圖8:再吸附氯離子,構成膠體粒子 |
圖9:電雙層的形成 |
圖10:膠團形成的示意圖
硫化砷溶膠:將氫硫酸溶液(H2S)與亞砷酸溶液(H3AsO3)作用,可製得硫化砷溶膠,其化學反應式,如[5]所示:
與H+,其解離反應式,如[6]所示:
而帶負電。帶負電的粒子吸引溶液中帶正電荷的氫離子(),膠核與吸附層構成「膠體粒子」。因為膠體粒子吸附的數目大於,故此膠體粒子帶負電。帶正電的膠體粒子再以疏鬆的方式吸引,構成「膠團」。膠團的示意圖,如圖11所示。
圖11:膠團形成的示意圖
n解答二:膠體溶液的凝聚說明
明白為何「金屬的氫氧化物帶正電,金屬的硫化物則帶負電」之後,此處就要論及膠體溶液的凝聚。膠體溶液凝聚常用的方法有三:加熱、通電與加入電解質溶液。加熱是克服因膠體粒子帶電而互斥,以致無法形成夠大的顆粒以生成沉澱;通電則是利用溶膠的帶電性,讓帶電的溶膠移向不同電性的電極,去除所帶電荷而凝聚,此一方法亦可驗證溶膠帶何種電荷,圖12即是通電後,氫氧化鐵溶膠移向負極並凝聚,可驗證氫氧化鐵溶膠確實帶正電;
:通電後,氫氧化鐵溶膠移向負極並凝聚
(圖片來源:小林正光、野村祐次郎、本岡達、內藤周弌,化學(第三版),數研出版株式會社,p 2。)
。硫化砷溶膠帶負電,所以加入帶較多電荷的陽離子效果較好,如Mg2+、Ca2+優於Na+,Al3+ 又優於Mg2+、Ca2+。
表一:電解質對溶膠的聚沉值(mmol/L)
|
Fe(OH)3(正溶膠) |
Al2O3(正溶膠) |
As2S3(負溶膠) |
|||
|
NaCl |
9.25 |
NaCl |
63.5 |
NaCl |
51 |
|
K2SO4 |
0.205 |
K2SO4 |
0.303 |
CaCl2 |
0.65 |
|
MgSO4 |
0.22 |
K2Cr2O7 |
0.63 |
MgSO4 |
0.81 |
|
K3[Fe(CN)6]
|
0.08 |
1/2Al2(SO4)3 |
0.096 |
||
n參考資料
普通化學(第三版),浙江大學普通化學教研組編,高等教育出版社。
近代物理化學(第三版),朱志昂主編,科學出版社。
膠體及界面化學入門(Introduction to Colloid and Surface Chemistry 4/e),Duncan J. Shaw原著,張有義、郭蘭生編譯,高立圖書有限公司。