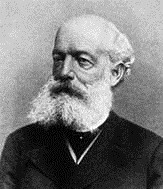坎尼札羅對原子量和分子量的探索 /游文綺、胡景瀚
坎尼札羅對原子量和分子量的探索
游文綺、胡景瀚*
國立彰化師範大學化學系
[email protected]
前言
透過實驗結果準確地證實亞佛加厥分子假說),成功地揭開原子世界的謎團。坎尼札羅的重要發現Cannizzaro, 1858)是
1. 等體積的氣體中包含相同數量的分子,但原子數量不同;
2. 氫分子、氧分子、鹵素分子都包含兩個相同的原子,金屬中的原子皆個別存在;以及
3. 運用氣體密度和杜龍–柏蒂定律Dulong–Petit law)決定原子量。
坎尼札羅的圖像如圖1所示,他將氫氣的密度定為2,將其視為2個原子的組成。分析氣體分子的密度後得到正確的相對原子量,以及分子的原子組成。他提出的正確原子量幫助門得列夫製作出週期表。坎尼札羅的論文如同一部時光機,讓我們回到十九世紀的科學思維。本文作者導讀該文部分的內容如下所述,以便快速地瞭解早期坎尼札羅提出原子量和分子量的探索歷程。
圖1:斯坦尼斯勞·坎尼扎羅
(圖片來源:Stanislao Cannizzaro, Wikipedia,
https://en.wikipedia.org/wiki/Stanislao_Cannizzaro.)
關於原子質量的探索之路
Jean
Baptiste André Dumas1811年發表亞佛加厥定律:相同體積的任何氣體,在相同的溫度和壓力下,具有相同數量的分子1814年獨立於亞佛加厥發表同樣的定律,也得出類似的結論。杜馬斯於1826年發表原子理論,並制定透過蒸氣密度確定原子量的方法)。然而,坎尼札羅特別強調等體積的氣體中含有相同數量的分子,但原子數量不同,在研究原子重量時切勿混淆數量和重量,並需要明確區別分子和原子。
坎尼札羅直言不諱地指出當時科學界的困擾來自於對元素和原子觀念的混淆。他也指出研究原子的科學家們必須要先理解關於氣態物質的性質以及給呂薩克定律的重要性。給呂薩克定律:同溫同壓下,氣體相互之間依簡單體積比進行反應,生成的氣體產物也與反應氣體的體積成簡單整數比。
當時,整個化學界深受貝采利烏斯)和在當代就鼎鼎有名的道爾頓思想。電化二元論認為原子帶電荷,化學反應是電荷相反的原子相互中和,因此,氫氣或氧氣就只能是單一原子,不可能是雙原子分子,這個理論間接說明沒有雙原子分子的存在。道爾頓也認為純元素的物質都是以單原子的形式存在。貝采利烏斯的理論雖然合理,卻隱藏一個重大的錯誤,一個我們今日輕而易舉能夠辨識的錯誤。他堅信鹽酸(氯化氫)、溴化氫、碘化氫、水和硫化氫都含有相同數目的氫,這種觀點在當時的學術氛圍中竟然得到一定程度的認同。坎尼札羅已經敏銳地看到觀念背後的盲點,他指出只需要區分原子和分子,就能調和貝采利烏斯的實驗結果,並適用於所有情況。
上述的研究都是物質在氣態狀態下進行,當時物理學家對氣態物質做出許多研究,包含1858年克勞修斯Rudolf Clausius, 1858)。這一結論不僅是理解氣體物質特性的關鍵,也為給呂薩克定律的解釋提供基礎。
揭示元素重量背後的驚人發現
坎尼札羅深信當時科學家之間的歧見與誤解主要源於對原子與分子差異的不瞭解。為了解決這個問題,他堅持應用亞佛加厥和安培的理論,這也成為他論述的基石。他提出的第一個觀點是視氫氣為標準單位,一體積氫氣密度定為2,這樣氣體的相對密度就可以視為分子的相對質量。他開始研究物質在氣態狀態下的密度,也就是分子的相對質量來確定各種化合物,並且對其進行元素分析,如表1所示,此表僅列出原著的部分物質,而且表中的英文元素符號為本文作者所加。然而,同一物質在其不同的同素異形體狀態下,具有不同的分子量,這一點還需要進一步確認。
表1:單位體積物質的重量及其重量組成
|
物質名稱 |
單位體積物質的重量 |
單位體積物質的重量組成 |
|
氫原子 |
1 |
1 (H) |
|
氫分子 |
2 |
2 (H) |
|
氧原子 |
16 |
16 (O) |
|
氧氣 |
32 |
32 (O) |
|
水 |
18 |
16 (O) + 2(H) |
|
硫原子 |
32 |
32 (S) |
坎尼札羅發現,物質的組成成分之間的重量呈現整數倍數的關係,此類元素被稱為一個原子,例如:氫(H)為1、氧(O)為16、碳(C)為12,坎尼札羅將此數值或其整數倍定為物質的原子量。他更進一步指出我們可以在不知道元素分子量的情況下得到其原子量。如果我們知道碳原子質量的最大公因數為12,坎尼札羅認為「碳」不論是原子或是化合物,其原子量就是12或是12的整數倍,那麼在其為氣態揮發物質時可以推論其他原子的分子量,並列出化合物分子的表達方式,如表2所示。此表僅列出原文的部分物質。
表2:單位體積物質的元素組成及其重量組成
*H = 1、C= 12、O= 16、S= 32;有些分子組成的上標數值為原著的表示方式,與現代表示方式不同。
|
物質名稱 |
重量 |
元素重量組成 |
分子組成* |
|
一氧化碳 |
28 |
12 (C) + 16(O) |
CO |
|
碳酸 |
44 |
12 (C) + 32(O) |
CO2 |
|
硫化碳 |
76 |
12 (C) + 64(S) |
CS2 |
|
乙烯 |
28 |
24 (C) + 4 (H) |
C2H4 |
|
丙烯 |
42 |
36 (C) + 6 (H) |
C3H6 |
|
乙醚 |
74 |
48 (C) + 10 (H) + 16(O) |
C4H10O |
|
氯化氫 |
36.5 |
35.5 (Cl) + 1(H) |
HCl |
|
溴化氫 |
81 |
80 (Br) + 1 (H) |
HBr |
|
碘化氫 |
128 |
127 (I) + 1 (H) |
HI |
|
乙醇 |
46 |
6 (H) + 16 (O) +24(C) |
C2H6O |
|
一氧化碳 |
28 |
16(O) + 12(C) |
CO |
坎尼札羅在此表格中揭示化合物的原子組成,但是對於化合物分子的表示方式,杜馬斯提出一個有趣的問題。在他那本經典的論文《關於原子理論的若干問題》中,杜馬斯暗示一個困擾化學家的問題—如果化合物中元素的係數與組成的氣體體積有關,那麼很多係數會是分數,可能會增加表達的複雜性
鹵素化合物的重新詮釋
舉例來說,針對鹵素化合物,由於我們知道它們在氣態下的密度,因此可以從氯化氫、溴化氫及碘化氫的密度得到氯、溴及碘原子的質量。然而,若要使用分子體積來表示原子的重量,則可能會遇到一些不便之處。例如:物質無法被氣化時就無法確定分子的重量,同素異形體)的質量也可能不同,這會使化學式的表示形式變得繁複。為了解決這些問題,坎尼札羅提出化合物分子組成用原子表示的論點。如果我們使用原子來表示分子的組成,就可以清晰地看出類似的化合物在其分子中含有相同數量的原子。
解決化合物分子的表示方式之後,坎尼札羅注意到在鹵素化合物中,運用密度從氯化汞和氯化亞汞的分子量推論到汞的原子量都是200。令人驚訝的是,這數據與現代原子量非常接近,卻與同時期科學家所接受的汞原子量為100的數值截然不同。坎尼札羅強調氯、溴及碘原子的質量都是其氣體分子的一半,分別是35.5、80及127。
為了進一步驗證汞的原子量,坎尼札羅運用另一種類似於杜龍–柏蒂定律Dulong–Petit lawcal/(°Cg)〕乘以其原子量為一常數,可以驗證汞的原子量近於200,如表3所示。
–柏蒂定律驗證結果
|
元素 |
原子量 |
單位質量比熱 |
比熱乘以原子量 |
|
固態溴 |
80 |
0.08432 |
6.74560 |
|
固態碘 |
127 |
0.05412 |
6.87324 |
|
固態汞 |
200 |
0.03241 |
6.48200 |
,如表4所示。
表4:化合物經過杜龍–柏蒂定律驗證結果
*分子式的上標數值為原著的表示方式,與現代表示方式不同。
|
分子式* |
分子量 M |
比熱 C |
MxC |
MxC/n |
|
n= 2 |
||||
|
KCl |
74.5 |
0.17295 |
12.884775 |
6.442387 |
|
NaCl |
58.5 |
0.21401 |
12.519585 |
6.259792 |
|
KBr |
119 |
0.11321 |
13.47318 |
6.73659 |
|
NaBr |
103 |
0.13842 |
14.25726 |
7.12863 |
|
n= 3 |
||||
|
HgCl2 |
271 |
0.06889 |
18.66919 |
6.22306 |
|
ZnCl2 |
134 |
0.13618 |
18.65666 |
6.21888 |
|
SnCl2 |
188.6 |
0.10161 |
19.163646 |
6.387882 |
|
MnCl2 |
126 |
0.14255 |
17.96130 |
5.98710 |
金屬自由基飽和能力的差異
坎尼札羅觀察到金屬原子和氯原子結合時,有的與一個氯原子結合,有的則與兩個氯原子結合。他認為分子組成上的不同是因為在化合物中各種金屬飽和能力1個帶正電的氫原子會被1個帶負電的氯原子飽和。他以氫原子作為類比,指出在不同情況下,金屬原子相當於1個或2個氫。例如:甘汞(Hg2Cl2)的汞原子的飽和能力相當於1個氫,而在腐蝕性昇華的氯化汞(HgCl2)中,汞原子的飽和能力相當於2個氫。鉀、鈉及銀的飽和能力相當於1個氫,而鋅、鉛、鎂及鈣等的飽和能力相當於2個氫。根據這個結果,坎尼札羅更加確信貝采利烏斯的錯誤,因為電化學二元論排除同核雙原子分子的可能性。
在原子之亂多年以後,坎尼札羅在1960年國際化學大會—卡爾斯魯厄會議)中分享這篇文章,指出令科學界困惑的數據主要來自對於原子和分子的觀念上混淆,也明確定義原子為元素的最小單位,這讓科學界重新檢視亞佛加厥所提出的假說,解決關於決定原子質量長久的混亂局面。
參考文獻
Amadeo Avogadro (1811). Essay on a manner of determining the relative masses of the elementary molecules of bodies, and the proportions in which they enter into these compounds. Journal de Physique. vo1. 73, pp. 58-76. [Alembic Club Reprint No. 4]
Pasteurbrewing (2024). Jean Baptiste Dumas (1800-1884). Retrieved March 1, 2024 from https://www.pasteurbrewing.com/jean-baptiste-dumas/.
Rudolf Clausius (1858). On the mean lengths of the paths described by the separate molecules of gaseous bodies. The Kinetic Theory of Gases: An Anthology of Classic Papers with Historical Commentary. History of Modern Physical Sciences. vol. 1, pp. 135-147. (Originally published under the title “Ueber die mittlere Länge der Wege, welche bei Molecularbewegung gasförmigen Körper von den einzelnen Molecülen zurückgelegt werden, nebst einigen anderen Bemerkungen über die mechanischen Wärmetheorie”, Annalen der Physik, Vol. 105, pp. 239–58 (1858).
Cannizzaro (1858). Lettera del Prof. Stanislao Cannizzaro al Prof. S. de Luca; sunto di un corso di filosofia chimica, fatto nella R. Universita’ di Genova. Nuovo Cimento, vol. 7, pp. 321-366.