臺灣化學教育
Chemistry Education in Taiwan
說明溶液的凝固點下降
施建輝
國立新竹科學園區實驗高級中學
教育部高中化學學科中心
schemistry0120@gmail.com
n 教師如何向學生說明「溶液的凝固點下降」?
在「溶液的性質」這一章中有一個小節:「溶液的沸點與凝固點」,主要的概念是「溶液的沸點上升」與「溶液的凝固點下降」,前者比較容易說明,學生在理解上比較沒有問題,但是後者不容易說明清楚,請問有沒有比較好的方式以說明「溶液的凝固點下降」這個概念?此外,某些教科書上特別強調:「溶液的沸點上升」與溶質種類有關,「溶液的凝固點下降」則與溶質種類無關,為什麼?
n 先談凝固點的定義
答覆內容:此一問題,高中化學的前輩教師薛勝雄老師於1983年出版一套「新細說化學」,對「溶液的凝固點下降」已有精闢的解說,本人不敢掠人之美,僅能就薛勝雄老師當年書上解說方式與參考一些資料,將這個問題一步一步解析,給對這部份有需要的老師們參考。解析內容如下:
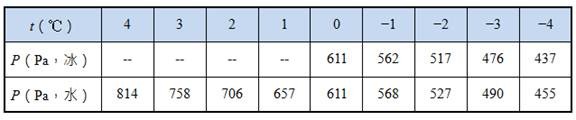
1. 以水為例,其固相與液相在不同溫度下的蒸氣壓如表1。
表1:冰和水在不同溫度下的蒸氣壓
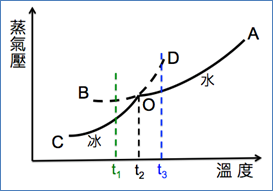
2. 繪製表1中冰與水的蒸氣壓與溫度的關係,得到圖1。
(1) 水的蒸氣壓曲線為OA,OB則為過冷狀態的水,處於不穩定的狀態。
(2) 冰的蒸氣壓曲線為OC,OD則為過熱狀態的冰,亦處於不穩定的狀態。
(3) 冰的蒸氣壓曲線較水的蒸氣壓曲線陡,表示冰的蒸氣壓受溫度變化的影響較大,這是因為冰和水蒸氣的熵變比水與水蒸氣的熵變大。【註:熵變即亂度變化。】
圖1:純物質在固相和液相的蒸氣壓
(圖片來源:新細說化學,薛勝雄編著,建弘出版社)
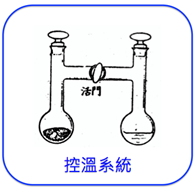
3. 圖2是凝固點測定裝置的示意圖,用以測定水的凝固點。這是一個密閉系統,其操作方式如下:
(1) 關閉中間活門,在左方容器加入冰,蓋上玻璃蓋,在右方加入水,蓋上玻璃蓋。
(2) 以控溫系統將溫度調至t1,打開活門。從圖1可看出,在此一溫度下,水的蒸氣壓大於冰的蒸氣壓,水將以蒸氣的方式移至左側變成冰,最後只剩固、氣兩相,無法達到固液共存的狀態,因此t1非凝固點。
(3) 將控溫系統溫度調至t3,打開活門。從圖1可看出,在此一溫度下,冰的蒸氣壓大於水的蒸氣壓,冰將以蒸氣的方式移至左側變成水,最後只剩液、氣兩相,也無法達到固液共存的狀態,因此t3也非凝固點。
(4) 只有將控溫系統溫度調至t2,打開活門後,因為冰的蒸氣壓等於水的蒸氣壓,冰與水達到平衡狀態,也就是達到固液共存的狀態,所以t2為凝固點。
圖2:凝固點測定儀器示意圖
(圖片來源:新細說化學,薛勝雄編著,建弘出版社)
n 為何溶液凝固點的會下降?
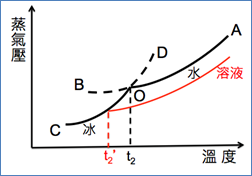
1. 圖3為溶液的蒸氣壓下降曲線圖。取出圖2右方容器上方的玻璃蓋,加入某溶質,例如葡萄糖,則右方容器內所存在的是葡萄糖溶液,在前面的章節已經學過:「溶液的蒸氣壓下降」,因此溶液的蒸氣壓從OA向下移至如圖3之紅色曲線。
圖3:溶液的蒸氣壓下降
2. 若控溫系統溫度為t2,從圖3可看出,在此溫度下,冰的蒸氣壓大於溶液的蒸氣壓。
(1) 打開活門,冰將以蒸氣的方式移至右側變成水,最後只剩液、氣兩相,無法達到固液共存的狀態,所以t2已經不是凝固點。
(2) 為使冰的蒸氣壓等於水的蒸氣壓,也就是達成固液共存的狀態,必須將溫度降為t2’。
(3) t2’< t2,可證實溶液的凝固點確實下降了。
n 為何溶液的沸點上升與溶質種類有關?而凝固點下降與溶質種類無關?
一、 溶液的沸點上升與溶質種類的關係
1. 圖4為液體和溶液的沸點與大氣壓力關係的示意圖,其關係說明如下:
(1) 液體在任何溫度都有能量較高的粒子掙脫其他粒子的束縛變成氣體,此現象稱為汽化或蒸發。
(2) 若加熱液體,將有更多的粒子汽化,甚至在液體內部形成氣泡。
(3) 若溫度不夠高,則氣泡的蒸氣壓力太小,無法抵抗大氣壓力,此一氣泡將消失。
(4) 需加熱到某一溫度t,氣泡內蒸氣壓力可抵抗大氣壓力與液體壓力,此一氣泡將上升至液面而逸出。在液面時,氣泡內蒸氣壓至少要等於大氣壓力。
(5) 此溫度t即為該液體的沸點。
圖4 液體的沸點與大氣壓力
(圖片來源:化學,野村祐次郎、小林正光合著,數研出版)
2. 若在液體中加入非揮發性溶質,則溶液的蒸氣壓將會下降,也就是說氣泡的蒸氣壓力也會下降且小於大氣壓力,此氣泡將無法存在,溶液也無法大量汽化,因此沸點不是t。此時必須繼續加熱,讓溫度高於t,才能再度看到沸騰現象,所以「溶液的沸點上升」了。
3. 若在液體中加入揮發性溶質,則氣泡的蒸氣壓力除了來自原來溶劑的蒸氣壓力,還加上來自揮發性溶質的氣體壓力,總壓力將大於大氣壓力。因此,此溶液在溫度低於t時就可看到沸騰現象,以致「溶液的沸點反而下降」了。
4. 由上述2、3兩點的不同結果,可得到以下結論:「溶液的沸點與溶質是否具有揮發性有關,也就是溶液的沸點與溶質的種類有關」。
二、 溶液的凝固點下降與溶質種類的關係
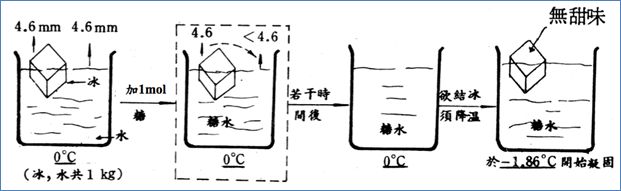
1. 圖5為在1大氣壓下,水中加入非揮發性溶質。在圖5中最左圖,冰和水在1 atm、0℃下,兩者的蒸氣壓皆為4.6 mmHg,也就是冰與水達成平衡,此時固液共存,因此0℃為水的凝固點(或冰的熔點)。
2. 當在水中加入非揮發性溶質,例如糖,則溶液的蒸氣壓力將下降,而冰的蒸氣壓不受影響,因此冰的蒸氣壓大於溶液的蒸氣壓,冰將以蒸氣的方式移至糖水中,最後只剩液、氣兩相,無法達到固液共存的狀態,因此0℃已經不是凝固點。
3. 在一開始「先談凝固點的定義」2-(3)這段文字中已經提到「冰的蒸氣壓曲線比水的蒸氣壓曲線陡」,也就是溫度改變時,冰隨溫度上升其蒸氣壓上升較快,當溫度下降時其蒸氣壓也下降較快。根據這個概念,為使冰的蒸氣壓等於溶液的蒸氣壓,也就是達成固液共存的狀態,必須將溫度下降。在圖5的最右方圖中就是以控溫系統調降溫度,依據水的質量與所加溶質莫耳數,當溫度降至−1.86℃時,冰塊再度出現,且冰塊不具甜味。也就是說−1.86℃是此時溶液的凝固點,可見「溶液的凝固點下降」了。
圖5:在1大氣壓下,水中加入非揮發性溶質
(圖片來源:新細說化學,薛勝雄編著,建弘出版社)
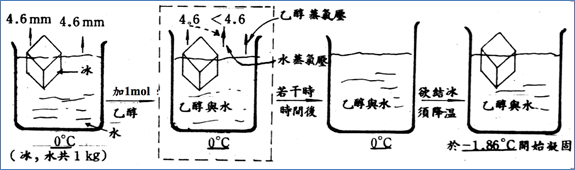
4. 圖6為在1大氣壓下,水中加入揮發性溶質。若在水中加入揮發性溶質,例如乙醇,則密閉容器內將同時存在水與乙醇的蒸氣壓力,但水的蒸氣壓力將比原有純水小,而冰的蒸氣壓不受影響,因此冰的蒸氣壓仍然大於溶液的蒸氣壓,冰仍將以蒸氣的方式移至溶液中,最後只剩液、氣兩相,無法達到固液共存的狀態,因此0℃仍然不是凝固點。
5. 那乙醇蒸氣扮演何種角色?在結晶學中強調晶體只容許與晶核相同的粒子才能附著其上,所以乙醇蒸氣的多寡與冰是否存在無關。這一點在此段文字第3點「加糖」中提及「再度出現的冰沒有甜味」,就是這個概念。
6. 同上,為使冰塊再度出現,溫度也必須降至−1.86℃,−1.86℃就是此時溶液的凝固點。可見「溶液的凝固點仍然下降」了,而且下降的溫度與加入同莫耳數的糖一樣。
7. 由加入糖或乙醇的結果,可得到結論:「溶液的凝固點與溶質是否具有揮發性無關,也就是溶液的沸點與溶質的種類無關」。
圖6:在1大氣壓下,水中加入揮發性溶質
(圖片來源:新細說化學,薛勝雄編著,建弘出版社)
n 結語
經過以上剖析,對於「溶液的凝固點下降」應已有充分的資料進行這個章節的教學。教學貴在「說清楚、講明白」,期望在所有高中化學教師彼此切磋下,能讓高中化學教學品質有所提昇。
n 參考資料
1. 新細說化學(1983),薛勝雄編著,建弘出版社。
2. 實用化學手冊(2001),實用化學手冊編寫組,科學出版社,。
3. 普通化學(第三版,1993),浙江大學普通化學教研組編,高等教育出版社。
4. 化學(1990),野村祐次郎、小林正光合著,數研出版。
老師您好,有關圖一有些疑惑百思不得其解,所以冒昧請教您:
1. 請問外在環境的壓力,是否會影響圖一中的曲線?
2. 如果1.的答案是會影響,那麼因為”OA線=三相圖中的液氣共存曲線,OC=三相圖中的固氣共存曲線”,所以得知外在環境壓力會影響三相圖的相態共存曲線,是否不合理?
3. 如果1.的答案是不會影響,那麼我們被教導”壓力愈大,水的凝固點會下降”,但圖一中的曲線的交會點凝固點是不會隨外在壓力變化的,這樣又該如何解釋呢?
有關上面的問題我自己覺得可能的解釋是:
(1)雖說”OA線=三相圖中的液氣共存曲線,OC=三相圖中的固氣共存曲線”,但其實蒸氣壓曲線與三相圖中的共存曲線需從不同角度進行思考。三相圖是指在外界壓力下,物質的三相變化,而蒸氣壓的測量本身就是在真空的環境下取得(氣體壓力計中的托里切利真空內的液體蒸氣壓力),當將蒸氣壓曲線與三相圖合併思考的時候,即可用來解釋液體的沸騰與昇華。由此可知,無論是三相圖的曲線或是蒸氣壓曲線,外在壓力僅是一個變數但不影響曲線的數值。
(2)如果(1)是對的,那麼氣體蒸氣壓=固體蒸氣壓的時候,應該是三相點似乎比較合理,因為注意到您文中提到的,當t2=0度C時將活門打開,此時冰和水和水蒸氣達到平衡(固液氣共存),且蒸氣壓力為611Pa(=0.006atm),我們知道三相點的壓力和溫度為0.006atm和0.0098度C(很接近0度C),這些條件都很符合水的三相點。
(3)如果以上都沒有錯誤的話,當液體蒸氣壓=固體蒸氣壓的時候,應為三相點,而凝固點會隨外在壓力變化而變化,因此在凝固點時,液體蒸氣壓不一定等於固體蒸氣壓,以水來說,只有在壓力為0.006atm時,凝固點的液體蒸氣壓才會等於固體蒸氣壓。
以上是我拜讀您的文章後得到的啟發和心得,自覺我的想法可能哪裡有誤但又無法找到原因,還請老師不吝解惑,謝謝您的撥冗閱讀,謝謝。
謝謝許先生的再度回應。這個專欄名稱定為「高中化學教學疑難問題與解題」,主要精神就是希望解決教學上有疑慮的內容,所以非常歡迎大家深入討論,以提升教學品質。對於您所提幾點,我就個人所知回應如下:
(1) 圖1中冰的蒸氣壓曲線,確實就是相圖中固氣共存曲線。
(2) 即使是固體仍有蒸氣壓,所以O點之蒸氣壓不會是0。圖1並未將整個座標劃為三個區域,所以並非等同三相圖,所以O點我在此文中視為固態與液態蒸氣壓相等的點。
註:我看過一本普化課本,內容提到將圖1的O點,以不同壓力實驗後,即會得到固液共存曲線,即熔化曲線,如此,O點即是三相點。這一部分我無法肯定,所以在本文中並未放進這個說法。由於您提出,我就提供這個資料供您參考。
(3) OB確實是過冷的水及其蒸氣共存的狀態。此時,因為活門已開啟,這個「過冷的水及其蒸氣」就必須與左方「冰及其蒸氣」取得平衡,由於右方容器內之水蒸氣壓較大,所以水蒸氣會以水分子的方式凝結在冰上,直到最後液態水消失。在文中,是以動態平衡的觀點論述,而非能量,若以熱力學而言,系統由高能量的過冷的水移至較低能量的冰,也是合理的。
您提供的「高中化學凝固點下降公式推導法之探討」確實是更好的方式,但是學生的背景知識不夠,恐難理解。本文就是提供老師們另一個解說的方式,依我個人教學經驗,學生的反應都不錯。
以上回應供您參考。也謝謝您對本文內容的迴響。
-
謝謝老師的補充解惑,敬請 教安
冰之蒸汽壓溫度關係圖形似乎有誤
-
謝謝許鈺琨先生的迴響。對於您所提「冰之蒸氣壓-溫度關係圖似乎有誤」,我做以下說明:這個關係圖是根據薛勝雄老師之「新戲說化學」與浙江大學「普通化學」兩書的內容,我不清楚您所謂的「似乎有錯」是錯在何處,這個專欄是開放的,不知您是否願意寫一篇內容更正稿,供更多化學教育者參考。我個人也曾撰寫一篇關於「硫酸銅晶體結構的探討」,之後發現自己有誤,馬上撰稿更正,也希望您願意來文更正。您另外提供的文章:「高中化學凝固點下降之探討」,誠如該文作者所提:「熱力學的推導方法對於一般高中生而言難度較高」,所以此篇以「圖示法」表示冰之蒸氣壓與溫度的關係。謝謝您的迴響。
-
謝謝施老師的提醒,先前的留言寫得很不清楚,先向老師致歉。敝人不敢為老師更正,僅在此提出我的疑惑,還望老師指導:
(1). 圖一中冰的蒸氣壓曲線是否是水的相圖中固氣共存曲線?
(2). 圖一中O點之蒸汽壓若不等於0,則該點是否並非固液共存,而是三相點?
(3). 文中所述「OB則為過冷狀態的水」是否是過冷之液氣共存狀態?又,液體之蒸汽壓過高故凝固成固體以達較低之蒸汽壓,此說法是否混淆了過冷的水之總能高於冰之總能的概念?誠如老師所引述的「熱力學的推導方法對於一般高中生而言難度較高」,但我疑惑的是此文所介紹之凝固點下降說明是否是『高中化學凝固點下降之探討』文中所謂「「依此(沸點上升圖示推導)類推」凝固點下降公式時,會發現根本無法以凝固點作圖,僅能用三相點來穿鑿附會。」。若答案是否定的,那我很高興學習到了一個好好說明凝固點下降的方法;若答案是肯定的,對我而言此說明雖然嚴謹卻比直接以三相點穿鑿附會來得複雜。
最後再次為先前之留言道歉,請老師解惑,謝謝!
-