
臺灣化學教育
Chemistry Education in Taiwan再談科學模型與建模—
從酸鹼模型發展史談起(中)
邱美虹
國立臺灣師範大學科學教育研究所
mhchiu@ntnu.edu.tw
n 酸鹼理論發展史的範例
以下主要是介紹Oversby(2000)對酸鹼理論模型發展史所提出的七個階段,並探討模型和建模歷程的本質和目的。
1. 行為模型(Behaviour Model):1777年以前,這是較早期的觀點,屬於描述型的模型。有關酸的基本性質包括以下幾點描述:
l 嚐起來是酸的,
l 會改變指示劑的顏色,
l 會與活潑的金屬產生反應產生氫氣,
l 會與碳酸化合物產生二氧化碳,
l 會與鹼起反應,中和後失去酸的性質。
當時的化學家根據這些性質或行為便可以進行預測,然而在這預測的過程中卻發現有些物質無法符合這些特性,如苯酚(C6H5OH),俗稱石炭酸,理當能與碳酸鈉或碳酸氫鈉
2. 卜利士力模型(Priestley’s Model):1772-1775年,模型觀:凡是含有氫的物質就是酸。
這模型主要是來自瑞典學者謝勒(Carl Scheele, 當時也在嘗試解釋燃燒實驗重量增加的問題),他將鹽酸和二氧化錳加在一起產生氯氣,並探索一些氯的氧化物的性質後,引發出兩種酸的想法: 一種是含氧的酸,另一種是含氫的酸。卜利士力是將這兩種酸組合成一個模型想法的人,他認為酸性氧化物溶於水造成酸性,所以所有的酸都含有氫。這一模型可以用反應式去表示反應狀況,而在中和反應時,酸和鹼的量的多寡決定產生鹽的量的多寡,這是採用化學計量的濫觴。這個模型具有以下四個解釋的功能:(a)酸中氫被金屬取代產生鹽、(b)金屬加入酸中產生氫氣、(c)有些酸性氧化物溶於水會形成氫氧化物、(d)能被金屬取代的氫稱為酸性氫。但是這模型終究是失效的,它無法有效地預測物質的酸鹼性。
3. 拉瓦節(Lavoisier’s Model):1777-1787年,模型觀:凡是含有氧的物質就是酸。
無疑地,這個想法來自於測試燃燒後的產物的性質,由於燃燒後的產物含有氧,所以酸性性質便是來自於氧化物的存在。在這個時期,三氧化硫(SO3)被視為硫酸(H2SO4),在當時溶劑的概念尚未形成,所以並不了解三氧化硫(SO3)溶於水後才是硫酸(H2SO4)。而鹽的產生就是酸的氧化物和鹼的氧化物反應後的產物,這種雙重觀點歸因於當時許多中和反應都是相反物質的反應。總之,在當時缺乏量化的概念,酸性就是化學物質本身的性質,然而當有些氧化物或非金屬不具有酸性性質時,這模型當然也就失效了。
4. 阿瑞尼斯模型(Arrhenius Model):1884年,模型觀:酸是一種在水溶液中會產生氫離子的物質。
這個模型來自於兩位化學家的實驗:勞特(Raoult)測量冰醋酸的凝固點下降的實驗和阿瑞尼斯(見圖一)進行不同溶液的導電性時所發展出來的科學模型(有關勞特和阿瑞尼斯在這方面的實驗說明,可參見de Berg, 2003),尤其是阿瑞尼斯模型可以解釋強電解質在稀釋溶液中導電的現象(但無法適用於中等濃度範圍),再加上Guldberg和Waage的觀點,解釋弱電解質在稀釋溶液中的導電也可以適用(Oversby, 2000)。阿瑞尼斯於其博士論文中提出解離不需如法拉第理論而需要外在電的來源時才能解離的觀點,受到其化學教授的反對,因此阿瑞尼斯剛開始並未太著重於解離說的推廣,但在遊走於歐洲拜訪其他科學家時,其解離說的觀點逐漸受到重視,於1887年正式被接受(de Berg, 2003)。而他所進行的實驗,包括有氫離子濃度的測量、pH值的尺度、酸的相對強度、解離常數(Oversby, 2000)、滲透壓(de Berg, 2003)等等,皆證明其理論的合理性且可量化,這些實驗的結果對化學界認識酸與電解質的性質產生突破性的影響。阿瑞尼斯的解離說在化學上的貢獻,使他在1903年獲得第三屆諾貝爾化學獎。可惜的是,每個模型都有其侷限性,阿瑞尼斯模型的限制就是僅能適用於水溶液中的解離。
圖一:阿瑞尼斯
(圖片來源:諾貝爾獎官網,http://goo.gl/Xtxb16)
簡單來說,阿瑞尼斯的模型就是化合物若含有H,且會釋放出H+,就是酸;若化合物可以解離出OH–,就是鹼。反應式如圖二所示:
HA(aq) → H+(aq)+ A–(aq)
酸
BOH(aq) → B+(aq) + OH–(aq)
鹼
圖二:阿瑞尼斯的酸鹼模型
5. 布–洛模型(BrØnsted–Lowry Model):1923年,模型觀:酸是提供質子的物質。
阿瑞尼斯模型的限制在布–洛模型中獲得解決。布忍斯特(Johannes BrØnsted)和洛瑞(Thomas Lowry)兩位化學家提出他們的酸鹼理論來解釋氯化氫和氨氣反應產生氯化銨的實驗,他們認為這反應就如同兩個物質在水中起中和反應是一樣的,不需要水作為溶劑也可以判斷孰是酸孰是鹼。他們的出發點是希望可以提出一個更根本的解釋模型來說明酸的特性,而這理論並不需要阿瑞尼斯理論中的水作為媒介(Oversby, 2000; Erduran, 2001)。相較於阿瑞尼斯模型,布–洛模型不受限於溶劑的種類或是否有溶劑參與(Oversby, 2000),突破過去的限制,同時此模式的主要優勢是在解釋物質之間質子轉移達到平衡時,物質酸性的相對強度。簡單來說,布–洛模型的提供質子的物質是酸(proton donor),接受質子的物質是鹼(proton acceptor)。至此,布–洛模型已經可以解釋相當多的酸鹼反應並預測正確。
圖三:Johannes N. BrØnsted(左)和Thomas M. Lowry(右)
(圖片來源:http://goo.gl/TUvsmh(左),http://goo.gl/P0xLKV(右))
HA(aq) + H2O → H3O+(aq) + A–(aq)
酸 鹼
圖四:布–洛的酸鹼模型
6. 路易士模型(Lewis Model):1923年,模型觀:酸是接受電子對的物質。
當氫在阿瑞尼斯模型和布–洛模型中都扮演重要角色的同時,氫的角色也備受挑戰,畢竟化學關心的是電子而不是氫,同時布–洛模型也未能涵蓋那些表現像酸或鹼可是卻不含氫的化合物(Erduran, 2001)。根據Brock(1992,引自Oversby, 2000)指出,路易士模型將重點從酸轉移到鹼的性質,並延伸其想法到鍵的形成和斷裂,以此觀點解釋酸鹼物質的行為是因酸和鹼產生共價鍵所致。然而,此模型與之前判斷何種物質為酸的理論不同,其所採取的定義是以鹼的電子結構來定義鹼,其適用範圍太廣,使得所有的反應幾乎都可以被視為是酸鹼反應,終致無法適用。
H+(aq) + :O2- → O ̶ ̶ H–(aq)
酸 鹼
圖五:路易士的酸鹼模型
7. 烏薩諾維奇模型(Usanovitch Model):1939年,模型觀:通則化的溶劑模型。
烏薩諾維奇的觀點是以離子之間的反應為重點,他認為陰離子為電子對的提供者,這模型考慮酸性物質在自我解離時,因為陽離子的濃度增加而呈現酸性。這模型的貢獻是將酸性物質的判斷從水溶液延伸到非水溶液系統。由於此種定義,幾乎包含所有反應、適用最廣,但是也因為如此,氧化還原反應亦包含於內,導致許多化學家無法接受此說法,因此目前已很少人使用此定義。其反應如圖六所示:
2NH3 → NH4+ + NH2–
2SO2 → SO2+ + SO32–
2CH3COOH → CH3COOH2+ + CH3COO–
圖六:烏薩諾維奇模型的說明
根據上述討論,將Oversby(2000)的觀點與酸鹼模型在自然領域課程綱要中的學習進展階段彙整如表一所示。
表一:酸鹼模型的發展與解釋類型
|
年代 |
化學家 |
酸的模型 |
溶劑 |
定義原子或離子 |
定義 鍵結 |
解釋類型 |
學習進展 |
|
~1777 |
未知 |
操作型 |
是(水) |
否 |
否 |
描述 |
小學 |
|
1772-75 |
含氫 |
是(水) |
是 |
否 |
詮釋、因果、預測 |
無 |
|
|
1777-87 |
拉瓦節 |
含氧 |
是(水) |
是 |
否 |
詮釋、因果 |
無 |
|
1884 |
阿瑞尼斯 |
釋放 氫離子 |
是(水) |
是 |
否 |
詮釋、因果、預測 |
國中 |
|
1923 |
布–洛 |
提供 質子 |
否 |
是 |
否 |
詮釋、因果、預測 |
高中 |
|
1923 |
路易士 |
提供 電子對 |
否 |
否 |
是 |
詮釋、因果、預測 |
(高中/ |
|
1939 |
烏薩諾維奇 |
溶劑 陽離子 |
是(任何溶劑) |
是 |
否 |
詮釋、因果、預測 |
(大學) |
註:彙整自Oversby(2000)表12.2、12.3和12.5。
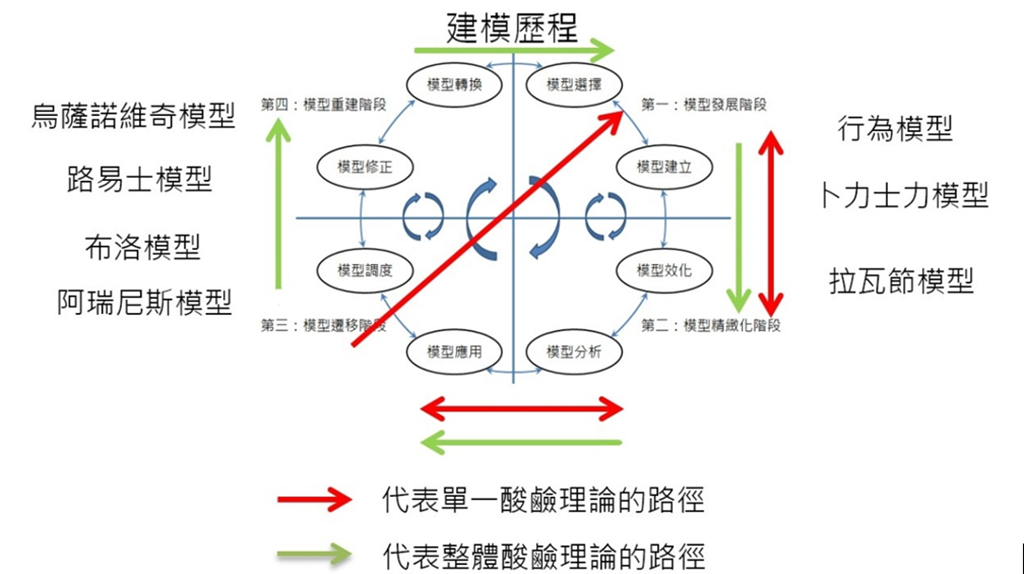
上述酸鹼學說發展史描述化學家根據不同解釋的面向而使用不同的模型來為酸鹼下概念型/操作型定義,在這過程中化學家進行實驗來驗證先前理論是否合宜、提出並評估自己的模型的價值及其適用範圍,再根據實驗數據加以修正模型,使其解釋力與預測力更加完善。邱美虹(2016)提出建模歷程的四個階段和八步驟分別是第一階段:模型發展階段,這一階段包含模型選擇與建立。第二階段的模型精緻化,在這一階段包含模型效化與分析。第三階段: 模型遷移階段,這一階段包含模型的近遷移和遠遷移。第四階段,即模型重建階段,這一階段包含模型修正和轉換。若以邱美虹(2016)建模歷程架構來探討酸鹼模型發展史(見圖七),〈行為模型〉可視為最初的酸鹼模型,以經驗導向的方式來判斷酸鹼的定義,透過觸覺、味覺等感官歸納出酸鹼物質的性質。此模型與生活經驗有直接的相關在酸鹼發展史中最早出現,也適用某些狀況下,因此〈行為模型〉從選擇主要的物質的酸性特質(選擇)、建立酸性物質就是嚐起來酸酸的感覺(建立)、經過嘗試不同物質後(效化),發現此準則仍適用,可以有效地分辨酸性物質和鹼性(分析),以及應用到日常生活中食物的判斷(應用),顯示確有其可適用的範圍,且分辨物質的酸鹼性又回饋到原來的〈行為模型〉(在圖七中以雙箭頭表示),因此〈行為模型〉歷經建模的前三階段,但是也因為有些酸性或鹼性物質無法用簡單的感官去正確判斷其酸鹼性,因此所建立的〈行為模型〉無法完全適用,遂有後續〈卜利士力模型〉和〈拉瓦節模型〉兩種解釋模型的提出,這兩種模型被選擇出主要的酸性物質分別是氫和氧以後,便建構出酸的模型,透過實驗不同物質來效化與支持他們所提出的酸鹼理論模型,使其可以解釋所觀察到的科學現象。同理,他們也面對與〈行為模型〉一樣的命運,也就是說卜利士力認為凡是含有氫的物質都是酸的理論,遭遇許多反例遂導致理論必須被修正;同理,〈拉瓦節模型〉中有些氧化物不具有酸性物質的特性,所以他的解釋模型也失效;至此兩人的模型雖經過部分數據的支持,理論精緻化後,但適用範圍有限,無法完全遷移,模型便不適用。爾後,阿瑞尼斯提出強弱電解質在溶液中導電的情形來說明物質的酸鹼性質,這一模型較前面敘述的三種模型適用範圍較為廣泛,但因只適用在水溶液中,而限制其解釋力的範疇,其過程與前述模型相似,歷經建模第一、二、三階段。布忍斯特洛瑞所提出的解釋模型—〈布–洛模型〉,選擇質子為模型要素,將酸定義為提供質子的物質,鹼定義為接受質子的物質,此時模型解釋的科學現象更加廣泛,且不再受限於特定溶劑中(調度)。再加上效化、分析、到遷移階段其他化合物的檢驗與實驗數據的支持,至此布–洛模型已具備解釋大部分的酸鹼的條件,而取代阿瑞尼斯模型。雖然後續還有路易士模型和烏薩諾維奇模型,使酸鹼的定義不再侷限在水溶液中,且適用於自我可以解離的溶劑中。但在高中階段,布–洛模型已可以達到幫助學生判斷酸鹼反應可能的產物與反應的機制的目的。
在圖七中,紅線代表每一個單一酸鹼模型從發展階段、精緻化階段到遷移階段的發展路徑,同時也說明階段之間互相回饋的機制,故以雙箭頭表示彼此之間的關係。由於每一個酸鹼模型各自並未出現第四階段的重建過程,故此處紅線在遷移後因有可能終止發展,故紅線未進入重建階段。而綠線代表這些酸鹼模型整體而言是歷經四個階段,後面發展的酸鹼模型是要修正前面的定義,甚至發展出不同於先前的酸鹼模型,因此整體酸鹼模型發展史歷經模型發展階段、模型精緻化階段、模型遷移階段到模型重建階段,整體酸鹼模型是以線性前進的方式發展。雖然酸鹼模型發展史說明科學模型的發展未必每一階段的建模歷程皆會經歷,有時因其解釋力與預測力不夠完整與精確,在既有的理論上無法發展,只有放棄,而從其他角度切入;有時則是強化既有的理論適用範圍。若從Thagard(1992)概念革命的觀點觀之,酸鹼理論模型比較像是排斥(如〈卜利士力模型〉和〈拉瓦節模型〉兩個理論之間)或是後發展的理論取代之前發展的理論(如〈阿瑞尼斯模型〉和〈布–洛模型〉),這些都比較像孔恩的常態科學,基本上酸鹼模型的發展似乎並未進入到科學典範(paradigm)轉移,到達不可共量的程度。就如同阿瑞尼斯模型在某些情況下還是可以適用的。
圖七:建模歷程與酸鹼模型發展史之關係簡圖




Please give us your valuable comment