臺灣化學教育
Chemistry Education in Taiwan分子的永久偶極與分子結構對稱性之關係
洪敬明
國立交通大學應用化學所物化組
國立交通大學教育學程
n 前言
本人於2016年參加【高中基礎科學研習會】,聽到一位化學教師(教師甲)於分科研習的「教學疑難問題討論」時段,提出有關「丙烷分子具有極性的解釋」。該名教師轉述其同事(教師乙)的觀點,教師乙認為若以「極性鍵的向量和」來預測分子極性,則理想結構的丙烷分子應不具有極性,理想結構是指分子內所有相鄰原子的夾角皆為109.47°且所有C−H鍵長皆固定的結構。教師乙認為丙烷分子的極性是來自於真實結構的丙烷分子的鍵偶極無法完全抵銷,因此丙烷分子具有些微極性。而教師甲則認為理想結構的丙烷分子是具有極性的,且因丙烷分子的真實結構更接近平面,使鍵偶極矩部分抵銷,造成真實結構的丙烷分子極性反而較理想結構為低,即是以「分子對稱性」來預測分子極性。
由於以上兩個教師提出不同的論點,對於丙烷分子是否具有分子極性有不同的預測結果。本人對這個懸而未決的問題很感興趣,於研習結束後,查閱《高級中學選修化學課程綱要》(99課綱)高中三上物質構造的「鍵極性與分子極性」,找到一段文字敘述:「多原子分子的極性,由鍵極性與分子的幾何形狀決定。非極性分子指分子的偶極矩為0者,即鍵極性的向量和為0」,此處極性是指永久偶極(permanent dipole)。本人也進行簡易計算和資料蒐集,期望能釐清此一問題。以下為該次研習所提出的兩個論點和本人針對此一問題提出的新論點。
n 論點一:從極性鍵的向量和決定分子極性的觀點出發,推測理想結構的丙烷分子應該是沒有極性的。
分子偶極矩與極性共價鍵
分子是由原子所組成,當組成分子的原子不只一種時,因不同原子的電負度(electronegativity, EN)有所差異,造成形成鍵結時電子於不同原子間的分布不均勻。電負度較小的原子對電子的吸引力較小,一般帶部分正電(![]() );反之,電負度較大的原子則帶部分負電(
);反之,電負度較大的原子則帶部分負電(![]() ),這種正負電荷相距一段距離的狀態稱為電偶極(electric dipole),而電偶極的大小一般使用分離的正、負電荷(庫倫)的絕對值大小,乘以正、負電荷的距離(公尺)來表示,稱為電偶極矩(electric dipole moment),單位為debye,簡寫為D(
),這種正負電荷相距一段距離的狀態稱為電偶極(electric dipole),而電偶極的大小一般使用分離的正、負電荷(庫倫)的絕對值大小,乘以正、負電荷的距離(公尺)來表示,稱為電偶極矩(electric dipole moment),單位為debye,簡寫為D(![]() C.m),方向由正電方位指向負電方位。大致而言,電負度差小於1.7的原子所形成的鍵結為共價鍵,等於0者或趨近於0者為非極性共價鍵,偏向1.7者為極性共價鍵,大於1.7者為離子鍵。但有少數例外;例如氟與氫間的鍵結,其電負度差為1.9,但H−F鍵仍被認為是極性共價鍵。而分子的極性大小與方向可由分子內極性共價鍵的電偶極矩(以下將共價鍵的電偶極矩簡稱為鍵偶極矩)的向量和來描述。
C.m),方向由正電方位指向負電方位。大致而言,電負度差小於1.7的原子所形成的鍵結為共價鍵,等於0者或趨近於0者為非極性共價鍵,偏向1.7者為極性共價鍵,大於1.7者為離子鍵。但有少數例外;例如氟與氫間的鍵結,其電負度差為1.9,但H−F鍵仍被認為是極性共價鍵。而分子的極性大小與方向可由分子內極性共價鍵的電偶極矩(以下將共價鍵的電偶極矩簡稱為鍵偶極矩)的向量和來描述。
丙烷分子的極性討論
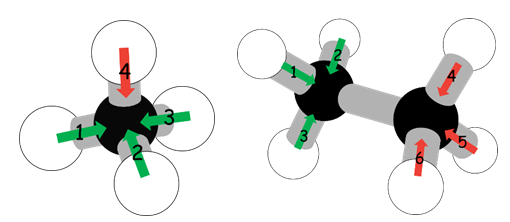
本人利用以下分子模型簡單闡述教師乙所提出的「論點一」。圖1左為甲烷分子的模型,因其結構的高對稱性(點群:Td)使得甲烷被歸類為非極性分子。若甲烷為非極性分子,表示其分子內各鍵偶極矩的向量和為0(鍵偶極矩 (1) + (2) + (3) + (4) = 0)。亦即,鍵偶極矩 (1) + (2) + (3) 的大小與鍵偶極矩(4)相同,且方向相反(鍵偶極矩 (1) + (2) + (3) = −(4))。圖1右為乙烷分子的模型,其中兩個碳原子因電負度相同,因此C−C鍵為非極性鍵。同時明顯可知,乙烷兩個碳原子分別構成的CH3(此處視為甲基),其中一個甲基的鍵偶極矩((1) + (2) + (3)),另一個甲基的鍵偶極矩((4) + (5) + (6)),兩者的向量和的大小相等、方向相反,其鍵偶極矩的向量和必為0,因此可得知乙烷為非極性分子,實驗結果也顯示乙烷為非極性分子。
圖1:甲烷的分子結構(左)和乙烷的分子結構(右)
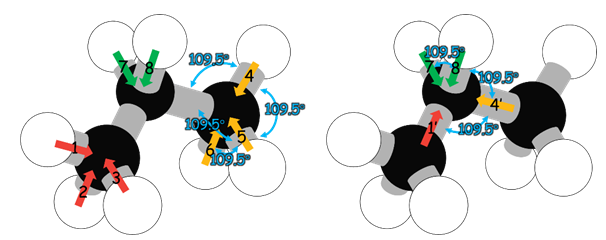
我們可以根據前面的結果來推測丙烷分子的極性。圖2左為丙烷分子的理想結構,丙烷上兩個甲基的碳原子與中心碳原子電負度相同,因此兩個C−C鍵應為非極性鍵(實際上並非完全沒有,請見後續討論)。以丙烷中間的碳原子當成中心原子,則左右分別鍵結兩個甲基,而其中一個甲基所造成的偶極矩為((1) + (2) + (3)),且從前面甲烷的例子中可知,其鍵偶極的向量和可視為單一C−H的偶極矩((1’));另一個甲基鍵偶極矩為((4) + (5) + (6)),且鍵偶極的向量和亦可視為單一C−H的偶極矩((4’)),如圖2右所示。圖2右的各鍵偶極矩將如同在圖1上甲基的四個C−H之偶極矩,且向量和為0(鍵偶極矩 ((1’) + (4’) + (7) + (8) = 0)。
圖2:丙烷分子的理想結構(左)和丙烷分子中兩甲基的電偶極矩於理想結構的向量和(右)
以上論點似乎言之有理,然而,本人查閱的資料呈現,實際上丙烷分子的電偶極矩的實驗值為0.084 debye而非為0。這要如何解釋「論點一」與實驗結果不符的事實呢?
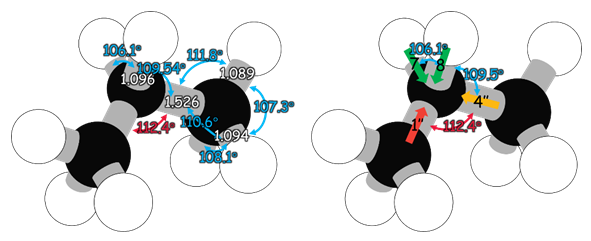
以下為教師乙所提出的解釋。丙烷分子當中兩個甲基間的立體排斥力,造成分子結構的變形(distortion),使得中間碳的∠CCC為112.4![]() 而非109.5
而非109.5![]() ,如圖3左所示,使得丙烷分子的結構偏離理想結構,也使得其鍵偶極矩無法完全抵消(鍵偶極矩(1’’) + (4’’) + (7) + (8) ≠ 0),而產生些微的極性,如圖3右所示。
,如圖3左所示,使得丙烷分子的結構偏離理想結構,也使得其鍵偶極矩無法完全抵消(鍵偶極矩(1’’) + (4’’) + (7) + (8) ≠ 0),而產生些微的極性,如圖3右所示。
圖3:丙烷分子的真實結構(左)和丙烷分子中兩甲基的電偶極矩於真實結構的向量和(右)(鍵長單位為Å)
n 論點二:即使是理想結構的丙烷還是具有極性,而甲基的斥力使丙烷分子結構更接近平面,反而使得丙烷極性下降。
此論點為教師甲提出的觀點,其主張因丙烷中兩個甲基的排斥力,造成丙烷的真實結構相較於理想結構較接近平面(理想結構的∠CCC(109.5![]() ) < 真實結構的∠CCC(112.4
) < 真實結構的∠CCC(112.4![]() ) < 180
) < 180![]() ),這使得丙烷的電子分布的更加對稱,反而使丙烷真實結構的電偶極矩較理想結構的電偶極矩為小,這事實可以藉由比較NH3分子與BF3的極性而加以驗證。
),這使得丙烷的電子分布的更加對稱,反而使丙烷真實結構的電偶極矩較理想結構的電偶極矩為小,這事實可以藉由比較NH3分子與BF3的極性而加以驗證。
n 討論:電偶極矩與分子對稱性
分子電偶極矩的本質
要釐清究竟上述兩論點何者較接近真實情況,首先我們需要瞭解分子電偶極矩的本質。如「論點一」中所提到,分子的極性大小與方向可由分子內極性共價鍵偶極的向量和來描述,一般教科書同樣也會提到類似的概念。然而,電偶極實際上是因為系統內電荷分布不對稱(對稱 ≠ 均勻,如BF3的例子裡,外圍F原子較中心B原子帶有較多的負電,兩原子的電荷分布不均勻,使得B−F鍵具鍵偶極矩,但因整個分子之電荷分布對稱而為非極性分子),因此分子的極性應該以分子的對稱性來判斷。
丙烷分子的極性討論
丙烷分子的碳鏈結構呈角形分布,而因兩個甲基的排斥力而使得碳鏈的夾角變大,整個碳鏈因此較偏向直線的結構。從對稱性的觀點來看,甲基的排斥力使丙烷分子由相對低對稱的角形變形為偏向相對高對稱的直線型,使得電荷分布較為對稱(嚴格來說是對分子對稱軸的方向更加對稱),而造成電偶極矩下降。因此,推測丙烷的理想結構的偶極矩應較真實結構的偶極矩大。
n 透過計算化學方法,定性模擬丙烷的電偶極矩與分子結構之關係。
目的和問題
為了檢驗前面兩論點何者較符合真實情況,本人以計算化學方法,計算丙烷分子於不同結構的電偶極矩大小,並確認以下兩個問題:
問題一:理想結構的丙烷分子是否具有極性?
若無極性,則較符合「論點一」的觀點;若有極性,則較符合「論點二」的觀點。
問題二:丙烷分子的極性是隨∠CCC變大而變大還是變小?
若是隨之變大,則較符合「論點一」的觀點;若隨之變小,則較符合「論點二」的觀點。
計算方法和條件
本人使用Gaussian09(套裝計算軟體),於CCSD(T)/aug-cc-pVTZ下計算下列三種結構的電偶極矩(其中Population analysis是以Hartree-Fock方法做計算)。
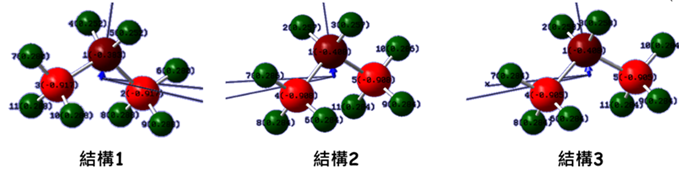
結構1:於美國國家標準技術研究所(Institute of Standards and Technology, NIST)中的計算化學資料庫(Computational Chemistry Comparison and Benchmark Database),查詢丙烷的真實結構(實驗基礎),其中∠CCC為112.4°。作為結構1。
結構2:以真實結構的鍵長,並將3個C上所有鍵結的角度固定為109.47°,作為結構2。
結構3:以真實結構中二級碳上的C−H鍵長(1.095 Å)為基礎,將結構2中所有C−H鍵長設為相同,作為結構3。
以下為計算結果,如表1和圖4所示。
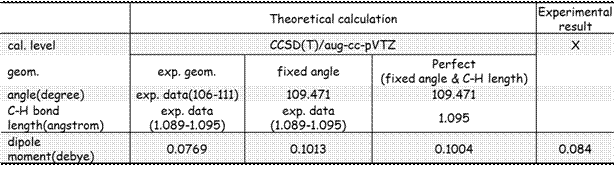
表1:丙烷的電偶極矩與分子結構的關係
圖4:根據理論計算得到三種結構中各原子的電荷分布
模擬結果與討論
由表一可以看出經實驗量測的丙烷分子的電偶極矩為0.084 debye,而本人利用NIST所提供的丙烷的真實結構(結構1)計算所得的的分子的電偶極矩0.0769 debye,相對誤差為8.5%。而對於所有鍵角為109.47°的結構2與結構3,其分子的電偶極矩分別為0.1013 debye與0.1004 debye。這些結果可以回答問題一:理想結構的丙烷分子還是具有極性的。此外,結構1的分子電偶極矩皆低於結構2與結構3的分子電偶極矩,其結果可以回答問題二:丙烷分子的極性是隨∠CCC變大而變小。此計算結果較支持「論點二」的觀點,也就是甲基間的立體排斥力,造成分子結構的變形,使得丙烷分子的對稱度提高,造成分子的電偶極矩下降。
除此之外,從圖4的三種結構中各原子的電荷分布,可以看出兩側接了三個氫原子的碳原子(甲基上的碳)相較於中心接了兩個氫原子的碳原子具有較多的負電荷,這顯示出雖然同樣為碳原子,因為受周圍原子的影響而有不同的電荷分布,因此實際上丙烷分子中的C−C鍵的電子分佈並不對稱。
n 利用群論分析分子的對稱性,推測分子是否具有電偶極矩。
目的
透過上面的理論計算,計算結果指出「論點二」(以分子對稱性預測分子極性)較為合理。除此之外,是否有更系統化的方式來描述分子對稱性與分子極性的關係?以下介紹極性鍵向量加成法的限制以及如何以群論判斷分子是否具有極性。
以極性鍵向量加成法預測分子極性的限制
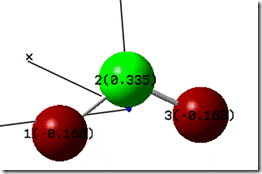
一般高中程度會利用個別極性鍵的電偶極矩之向量和,來估計分子是否具有極性。然而,此方法忽略了原子上的電子雲並非剛性結構,而是會隨著原子所處的環境而變形,使系統達到最低能量的穩定狀態。用此觀點,解釋丙烷上的C−C雖然同屬於碳原子,但兩者之電荷分布並不均勻,進而產生鍵偶極矩。用同樣觀點,也可以用來解釋臭氧分子(![]() )為極性分子的原因。從圖5的電荷分布,可以看出臭氧分子內兩側的氧原子帶部分負電,而中心氧原子帶部分正電,兩個O−O鍵實際上的電荷分布並不均勻,而產生了鍵偶極矩,且因分子結構不對稱,電偶極矩的向量無法完全抵消,使得臭氧分子具有極性。
)為極性分子的原因。從圖5的電荷分布,可以看出臭氧分子內兩側的氧原子帶部分負電,而中心氧原子帶部分正電,兩個O−O鍵實際上的電荷分布並不均勻,而產生了鍵偶極矩,且因分子結構不對稱,電偶極矩的向量無法完全抵消,使得臭氧分子具有極性。
圖5:臭氧分子的中各原子的電荷分布
群論分析與永久偶極
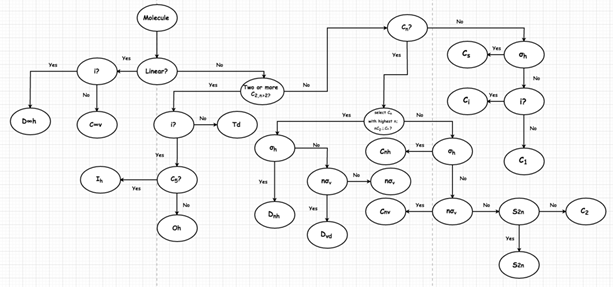
群論(group theory)是化學家常用來描述分子對稱性(molecular symmetry)的數學工具,我們可以對分子進行各種對稱操作,即可知分子所具有的對稱元素並推測分子是否具有永久偶極。將分子所具有的對稱元素按照特定規則分類,如圖6所示,可知該分子所屬的點群(point group),方便推測分子是否具有永久偶極。
從文獻資料可知,若分子具有對稱中心(inversion center, i)、水平對稱面(horizontal mirror plane, ![]() )或兩個以上的旋轉軸(rotation axes,
)或兩個以上的旋轉軸(rotation axes, ![]() ),則該分子不具有永久偶極。若按點群的對稱元素分類,則只有屬於
),則該分子不具有永久偶極。若按點群的對稱元素分類,則只有屬於![]() 點群的分子會具有永久偶極。
點群的分子會具有永久偶極。
丙烷與臭氧的對稱性與其電偶極矩
丙烷分子和臭氧分子(![]() )的點群皆為
)的點群皆為![]() ,電荷無法完全對稱分佈,推測為極性分子。且根據實驗數據可知其電偶極矩分別為0.084 debye與0.534 debye。
,電荷無法完全對稱分佈,推測為極性分子。且根據實驗數據可知其電偶極矩分別為0.084 debye與0.534 debye。
圖6:點群的分類規則(AbdullahAlturki99 @ https://goo.gl/5glvT1)
n 結語
本人以丙烷分子為例,介紹了兩種預測分子極性的方法,第一種為高中課本常見的鍵偶極向量加成法,第二種是分子幾何結構對稱法。透過計算化學方法檢驗兩者的適切性,說明第二種方法的適用範圍較廣,並介紹了如何以系統化的工具(群論分析)來描述分子對稱性與極性的關係。這篇文章可幫助高中化學教師瞭解分子極性的本質,並於學生詢問分子極性的特例時,除了請同學背下來,或是以共振結構來解釋鍵極性外,對於資質較好的學生還可說明分子極性的本質,並告知學生該議題於大學階段還可利用分子對稱性的觀點來分析並解釋。
n 參考資料
1. 選修化學(上),翰林出版社。
2. 施建輝,疑難問題集錦之一:有關離子安定性和分子偶極的問題,臺灣化學教育,第十五期,2016年09月。http://chemed.chemistry.org.tw/?p=19636。
3. Engel, Thomas and Reid, Philip. Physical Chemistry, Second Edition, 2010, Pearson.
4. 計算化學, Wikipedia, https://goo.gl/Zz78tg.
5. Computational Chemistry Comparison and Benchmark DataBase, NIST, https://goo.gl/Tzxa3Y.
6. Molecular symmetry_point group, Wikipedia, https://goo.gl/bNe0N4.
7. Molecular geometry_polarity, Wikipedia, https://goo.gl/aQjiII.
8. Dipole_molecular dipole, Wikipedia, https://goo.gl/YqwkmS.
9. Chemical polarity_Polarity of molecules, Wikipedia, https://goo.gl/st5O3E.
10. Chemical polarity_predicting molecule polarity, Wikipedia, https://goo.gl/I4eh8v.
11. Electric dipole moment_dipole moments of molecules, Wikipedia, https://goo.gl/BOR5CQ.
尊敬的洪教授:
拜讀大作,令人敬佩。
本人添為您的同好,更是有幸在閱讀大作後,收益匪浅。
𧫴提出淺見一則,作为参考。
依据資料所示,已可推測紅外線和拉曼对該材料的振動譜图,再和實測对比,不亦快哉。 即使不測,或限於時間,建議参考:徐經偉,牛利,髙翔,崔勐 " 波譜分析"科学出版社 2012
書中第九章一一讀来,並参考下述方程式,不才推演所得
Delta X (multiply) v(nu bar) = 1848.38 Square root( De/mu)
式中文字説明:鍵長伸長✖️ 伸張振動波数 等於 常数✖️ 【鍵能➗約化質量】平方根
只有delta X 是未知。在統計中可以按烷,烯……可能有一定範畴,不多説了…專此敬頌教安,並請指教,十分感谢。小兄李博士敬書