
臺灣化學教育
Chemistry Education in Taiwan
綠色化學創意競賽:
中和高中學生改良有毒的高錳酸鉀實驗
陳欣怡*、陳芊君
新北市立中和高級中學
*shinekudo@gmail.com
n 教師教學反思
學生常常問我(通訊作者):「為什麼要學化學?」,我起初總是回答:「生活上有許多可以用到化學的地方,你學好之後就可以好好應用。」但,每次上課學生總會問說:「老師,這題會不會考?」;「老師,這個要不要背?」;「老師,我們來考前猜題好不好?」…,這些問題讓我明白:「他們還是不懂學化學的功用和愉快」。因此,我嘗試在課堂上與學生討論時事,讓他們可以更加了解生活上的應用;把課本的實驗改變,讓他們方便了解原理與操作;設計專題課程〝新聞中的科學〞報告,除了讓學生們可以把所學的科學原理應用到生活上,更可以讓他們增加思考能力。另外,我也積極帶領學生組隊參加各項科學競賽,包括化學創意闖關比賽、旺宏科展、科學展覽、清華盃高中化學學科能力競賽…。透過這些活動,除了可以讓他們擴展視野之外,在競賽過程所遇見的各樣問題,透過彼此互相討論和搜尋資料尋找解決之道,而所有的過程是為了讓學生明白:學習應用的能力才是重點,而不是考試的分數!
n 師生參與過程
於學校的網頁上看到「綠色化學創意競賽」的活動訊息,深感化學和環保作結合的概念是十分重要的,我們每次進行化學實驗時,除了學習知識和技能之外,可以為環境做些事,讓地球永續發展更是重要。於是找了我任教的高二科學班的學生進行討論,科學班的學生,在〝專題課程〞中,除了有各種實驗進行之外,還有新聞中的科學報告(見圖一)和校慶成果發表(見圖二和圖三)等。此專題課程的目標,除了訓練基本的實驗能力和加深加廣的課程之外,還期待他們能透過實驗學習研究精神與良好的研究態度;透過上台報告學習投影片製作能力、訓練台風與欣賞批判的能力;透過校慶的科學班成果發表,學習自己籌辦活動能力與知識分享和對週遭環境的關懷。這一切都是希望學生們不再只侷限於紙筆的學習,處處斤斤計較於分數與漠視環境的破壞。而是能夠讓學生能「學會各種能力,貢獻所學,熱愛自然與科學。」
圖一:專題課程—新聞中的科學報告
圖二:專題課程—校慶成果發表盛況
圖三:專題課程—校慶成果發表海報
我在帶領學生的過程中,最讓我有感的事不是找尋主題和設計實驗,而是最後決定方法和理論結果後,開始驗證自己的推論,在實驗過程中芊君同學(第二作者)並不是很順利,而她總能非常有毅力與耐心地把問題一一化解,看到學生在實驗中實事求是的態度、百折不撓的研究精神與不求回報的決心,我自嘆不如,而看到她的努力研究終於獲得肯定,更是替她開心。但最開心的是:她得獎的心態,雖然她沒能上台報告,但在台下她卻能與不認識的同學們交流分享彼此的實驗。我知道,我們未來又多了一位人才!更是期待,她未來可以在她自己的領域發光發熱。
n 設計理念與改良
一、得獎作品
l 作品名稱:踏破「鐵」鞋無「錳」處,得來全是環保術。
l 參賽學生:陳芊君;指導教師:陳欣怡。
l 得獎名次:高中組綠色化學(減毒減量)創意競賽銅牌獎。
二、 設計理念
在現今環保意識高漲的時代,化學常被認為是不環保的、危害環境和傷害身體健康的,這種刻板印象導致許多人聞〝化學〞色變,而這樣的競賽,讓我們學習思考如何保護環境和認識正向的化學。
因此,在選擇要改良哪一個高中課本實驗時,我(第二作者)思考許久採用老師的提議改良「過錳酸鉀滴定草酸鈉」實驗,這是選自高三選修化學上氧化還原的教材,此實驗的目的是用來教導學生利用氧化還原滴定,求未知物濃度或含量。原課本實驗為:利用已知濃度的過錳酸根離子在酸性下與未知濃度的草酸根離子發生氧化還原,達到當量點時,在計算未知濃度的草酸根離子濃度。既然是用來教學,那麼對環境以及操作者本身危害大的錳離子應該被替換,從原本實驗的過錳酸根離子改為鐵離子。此一改良降低了反應物的毒性,也因實驗的改良而消失,大大的降低了整個實驗的毒性。在查閱電位表之後,決定「使用常見且危害性小的鐵離子代替錳離子」。
三、 涉及的原理和概念
此反應中,草酸根離子會失去兩個電子,而鐵三價離子會得到一個電子,反應式如式[1]所示。藉由「氧化還原的得失電子莫耳數會相等」的關係,能列出關係式[2]:
氯化鐵濃度 × 氯化鐵體積 × 1 = 草酸鈉濃度 ×草酸鈉體積 × 2 [2]
並且藉由關係式[2],算出未知的草酸濃度。
以碘作為指示劑,當達到當量點時,多餘的Fe3+與I–發生反應形成碘分子,與洗米水中的澱粉當作指示劑,產生藍黑色錯合物。
四、實驗過程
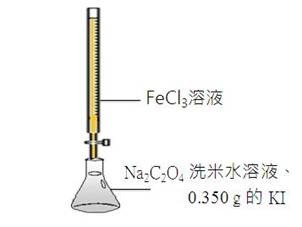
實驗的概要裝置圖如圖四所示。
圖四:實驗概要裝置圖
本實驗的詳細過程如下:
改良一:過錳酸鉀溶液更換為氯化鐵溶液
1. 配製未知濃度的FeCl3溶液:秤取3.25克的FeCl3倒入燒杯中,再加入少許的蒸餾水使溶解。溶解後倒入1000.0 mL容量瓶中,加蒸餾水至刻度線為止。
2. 用此溶液潤洗滴定管,並置入滴定管中。
3. 配製0.0500 M Na2C2O4洗米水標準溶液(以洗米水當溶劑並當指示劑):秤取1.675克的Na2C2O4倒入燒杯中,再加入少許的蒸餾水使溶解。溶解後倒入250 mL容量瓶中,加蒸餾水至體積250mL為止。
4. 於錐形瓶內置入5.0 mL的0.0500 M Na2C2O4洗米水溶液和0.350 g的KI。
5. 置入一支溫度計,並放置錐形瓶在恆溫水槽中,加熱至80℃。
6. 讀取在滴定管內FeCl3溶液的初讀數。開始滴定,達滴定終點時,溶液成深藍色。讀取FeCl3在滴定管內的末讀數。
7. 重複以上步驟五次後,算出五次實驗所使用的FeCl3劑量。
8. 算出五次實驗所得的FeCl3濃度,求其平均值。
改良二:降低溫度
1. 與改良一的步驟1~4相同。
2. 置入一支溫度計,並放置錐形瓶在恆溫水槽中,加熱至70℃、60℃、50℃、40℃。
3. 重複與改良一的步驟6~8。
改良三:降低草酸鈉溶液的濃度
1. 與改良一的步驟1~2相同。
2. 配製0.0250 M Na2C2O4洗米水標準溶液(以洗米水當溶劑並當指示劑):取50 mL配製好的0.0500 M Na2C2O4,倒入100.0 mL容量瓶內,加蒸餾水至刻度線為止。
3. 於錐形瓶內置入5.0 mL的0.0250 M Na2C2O4洗米水溶液和0.350 g的KI。
4. 置入溫度計,並放置錐形瓶在恆溫水槽,加熱至50℃。
5. 重複與改良一的步驟6~8。
改良四:草酸鈉溶液改為草酸溶液
1. 與改良一的步驟1~2相同。
9. 配製0.025 M H2C2O4洗米水溶液標準溶液(以洗米水當溶劑並當指示劑):秤取0.225克的H2C2O4倒入燒杯中,再加入少許的蒸餾水使溶解。溶解後倒入100.0 mL容量瓶中,加蒸餾水至體積100mL為止。
2. 於錐形瓶內置入5.0 mL的0.0250 M H2C2O4洗米水溶液和0.350 g的KI。
3. 置入一支溫度計,並放置錐形瓶在恆溫水槽中,加熱至50℃。
4. 重複與改良一的步驟6~8。
改良五:減少碘化鉀的使用量
1. 與改良一的步驟1~2相同。
2. 配製0.025 M H2C2O4洗米水溶液標準溶液(以洗米水當溶劑並當指示劑):取改良四中配製的0.025 M H2C2O4洗米水溶液使用。
3. 於錐形瓶內置入5.0 mL的0.025 M H2C2O4洗米水溶液和0.250 g的KI。
4. 重複與改良一的步驟6~8。
五、 實驗結果與討論
改良一:過錳酸鉀溶液更換為氯化鐵溶液
反應溫度:80℃;氯化鐵溶液測定濃度:0.0199 M;氯化鐵溶液配製濃度:0.0200 M;
誤差:–0.5%。實驗結果的準確度佳、可行性亦佳。
改良二:降低溫度
滴定時,氯化鐵溶液配製濃度:0.0200 M,控制不同溫度的實驗結果如表一所示。
表一:控制不同溫度的實驗結果
|
溫度(℃) |
80 |
70 |
60 |
50 |
40 |
|
推算濃度(M) |
0.0199 |
0.0200 |
0.0200 |
0.0199 |
— |
|
誤差(%) |
–0.5 |
0 |
0 |
–0.5 |
— |
滴定時,溫度控制在40℃下,氯化鐵與草酸鈉不反應。其餘溫度控制在80℃~50℃下,實驗結果的準確度極佳(誤差低於1.0%)、可行性亦佳。
改良三:減少草酸鈉溶液的濃度
降低Na2C2O4的濃度為原先的一半,FeCl3等體積稀釋,但使用劑量不變。反應溫度:50℃;氯化鐵溶液測定濃度:0.00962 M;氯化鐵溶液配製濃度:0.0100 M;誤差:3.8%。實驗結果的準確度尚可(誤差大於1%,小於5%)、可行性尚可。
改良四:改變草酸鈉溶液為草酸溶液
Na2C2O4改成H2C2O4,陰離子不改變。反應溫度:50℃;氯化鐵溶液測定濃度:0.00999 M;氯化鐵溶液配製濃度:0.0100 M;誤差:0.1%。實驗結果的準確度極佳(誤差低於1.0%)、可行性亦佳。
改良五:減少碘化鉀的使用量
Na2C2O4改成H2C2O4,陰離子不改變,碘化鉀用量減少。氯化鐵溶液測定濃度:0.00996 M;氯化鐵溶液配製濃度:0.0100 M;誤差:0.4%。實驗結果的準確度極佳(誤差低於1.0%)、可行性亦佳。
由本次的研究結果得知,在過錳酸鉀滴定草酸鈉的實驗中,若把過錳酸鉀溶液換成氯化鐵溶液,被滴定的草酸鈉改為草酸,且用洗米水當溶劑和當指示劑,減少碘化鉀的使用量,反應溫度降為50℃時,其實驗誤差很小,可以用來替代過錳酸鉀滴定草酸鈉。
六、 設計特點
l 此次改良選修化學(上)氧化還原滴定的實驗,更改毒性高的過錳酸鉀為無毒性的氯化鐵。
l 實驗結果顯示:若只用氯化鐵取代過錳酸鉀會無法辨識滴定終點,因此須加入少量碘化鉀當指示劑。
l 把被滴定的草酸鈉改為草酸,可以避免使用高危險性的硫酸。
l 降低反應溫度,以減少能源損耗。
l 洗米水代替澱粉,達到回收再利用。
n 參賽學生心得
一、參與契機
在校慶的活動中,我們探討〝食〞的安全。在高中基礎化學(二)第四章中,教導我們綠色化學的概念,我(第二作者)常常想:「人們常為了便利,在不知覺中破壞了生活環境。」為了能深入了解綠色化學,為了讓自己可以為環境盡一份心力,我思索著:「身為一位高中生,我可以做些甚麼事?」。當看到「綠色化學創意競賽」時,深覺這就是我可以為環境盡一份心力的事,因此果斷地參加了這競賽。
二、瓶頸難題
我的主題選定並沒有花費太多時間,但讓我覺得困難的事是,究竟甚麼藥品可以取代有毒性的過錳酸鉀﹖在蒐尋過各種物質的還原電位後,並與老師討論後,我決定利用氯化鐵來取代過錳酸鉀。原本過錳酸鉀除了當氧化劑之外,本身還可以當作指示劑,如果換成氯化鐵,那麼達當量點時顏色不明顯,這樣不就無法確定滴定終點了。為了這指示劑我找尋了許多資料,都沒有線索,在一次上課時,老師講到碘的直接和間接滴定,我突然想到可以如法泡製,於是選擇用碘化鉀並用洗米水中的澱粉當作指示劑。
在決定之後,我在實驗的過程中碰上了一些麻煩。在原來實驗中,過錳酸鉀在酸性下氧化力很強,反應比較明顯,而且高錳酸鉀顏色比較深,容易判定終點。然而,我換成鐵離子時,氧化力比較弱,如果指示劑加太多會造成實驗誤差;如果指示劑加太少,顏色會不明顯造成終點判定不易。
另外,滴定實驗本來就需要細心和耐心,對我這個性粗線條的人來說,這過程真是讓我吃足苦頭,常常一不小心就超過當量點很多了,為此我花了許多時間重複練習滴定技巧,來解決我的人為誤差。
三、成功喜悅
在實驗室裡進行了數十次的實驗,第一次成功的時候,我很擔心會誤判,還特別請老師幫忙判定滴定終點,當時我的心情非常忐忑,擔心是誤會一場,但老師說:「這顏色是正確的喔!」,那種開心是無法言喻的,但又擔心自己的粗心會造成誤差,因此我每次都會把藥品用量精準地記錄,並且重複相同的實驗五次,這樣方便我可以減少我的人為誤差。而實驗數據的處理後,看到的結果精準度都很高,這讓我手舞足蹈。
四、競賽報告
當同學告知競賽初審通過後,我和老師都非常開心,因為這是我第一次參加校外的比賽通過初審。但考驗又來了,雖然在專題課上我有多次上台簡報的經驗,但面對專業的大學教授們讓我非常的惶恐,因為這是我第一次到校外比賽,我不想要丟臉。還好有老師和同學們的幫忙,經過好幾次的演練、計時和修正。最後在比賽當天,我在等待區不斷演練,希望可以把演練的結果完美呈現在評審教授面前,當我關上那扇門時,我非常開心,因為我已經盡力了。
這次比賽讓我學習到的不只是書本上的知識和實驗的操作,而第二關的現場報告,則增進我們對外表達、說明的技巧,也給予我們接受教授指導和建議的機會,是許多高中生可遇不可求的。
五、得獎心情
在公佈得獎名單時,得知我獲得銅牌(見圖五),這是我第一次參加校外比賽獲獎,這讓我開心了好幾天,因為我的努力終於有收穫了。只是我認為我更大的收穫是:在頒獎典禮上,經由葉名倉教授的整理,濃縮所有得獎作品的要點,使我們可以快速交流彼此的想法,也讓我有機會和其他得獎者交換意見;教授同時傳授我們更多綠色化學的相關知識,使我們能夠增廣見識,彼此切磋可以激起更大的創意。
藉由這次比賽,在往後的實驗中,我更加注意藥劑的計量和實驗後所產生的物質回收,感謝主辦單位舉辦這個競賽,希望這樣能激起大眾對綠色化學的創新和關注,若我們願意多一步思考,不但可以改變大家對「化學是汙染環境的元兇」的刻板印象,還能更肯定化學對人類發展的必要性。
圖五:頒獎典禮獲獎
n 參考資料
1. 高中選修化學(上)第五章—氧化還原反應的氧化還原滴定。
2. 碘(Iodine),科學Online(高瞻自然科學教學資源平台)http://highscope.ch.ntu.edu.tw/wordpress/?p=4997。






Please give us your valuable comment