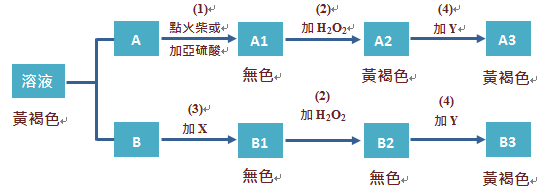
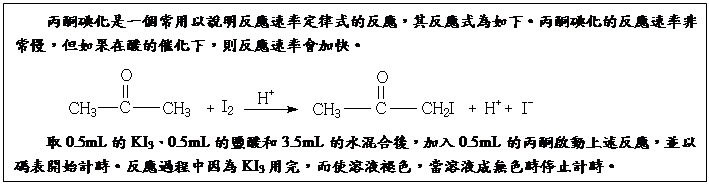
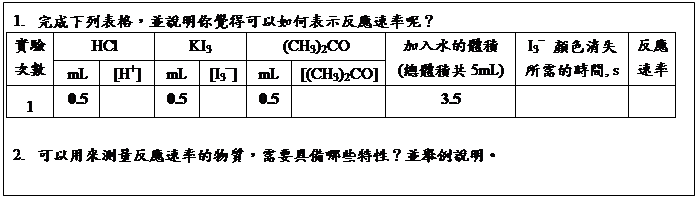
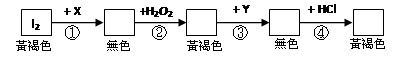慶祝IUPAC100&2019國際週期表年在臺灣(IYPT in Taiwan) 活動成果展示:第21期CASE探索基礎科學講座 /陳竹亭
慶祝IUPAC100&2019國際週期表年在臺灣(IYPT in Taiwan) 活動成果展示:
第21期CASE探索基礎科學講座
陳竹亭
臺大化學系名譽教授/遠哲科學教育基金會董事長 陳竹亭
1869年俄國的門得列夫(Dmitri Ivanovich Mendeleev, 1834-1907)(圖1)率先發表了第一個週期表。(圖2)週期表依原子量和元素化學、物理性質的週期性排列,總計有67個元素,其中有4個是預測了尚未發現的元素,到今年剛好是150週年。國際純粹與應用化學聯合會(IUPAC)也正逢100週年,正好慶祝化學史上極重要的週期表150年(PT150)。聯合國科教文組織(UNESCO)也共同慶祝推廣週期表與化學教育,就訂定2019年為國際化學元素週期表年(International Year of Periodic Table of Chemical Elements),簡稱為2019IYPT。
圖1、門得列夫(Dmitri Ivanovich Mendeleev, 1834-1907) 圖2、週期表依原子量和元素化學、物理性質的週期性排列
個講座,分別紀錄於下。
【第一講】是由陳竹亭教授開啟序幕,題目是「發現元素新大陸」。早在西元前3世紀,亞里斯多德提出包括「土、水、氣、火」的四元素論,直到17世紀,波以耳認為元素是物質不可再分解的部分,且堅信元素具有粒子性質。18世紀的拉瓦節透過燃燒實驗,主張燃燒乃是物質與氧反應,水是氫與氧化合的產物。他用實驗釐清了元素與化合物的概念,在1790年出版了《化學基本原理》,推動化學革命,被譽為現代化學之父。
(((約翰·斯特拉特 (John Strutt, Lord Rayleigh)則在19世紀末發現惰性氣體。
稱為「原子之父」的道耳頓於1803年提出「原子論」,坎尼乍若(Stanislao Cannizzaro)在1860年的國際化學會議裡演講,釐清了混亂的原子量,啟發了當時在座的俄國年輕化學家門得列夫。門得列夫最顯著的成就便是於1869年發表「元素週期表」,他預測的鎵、鈧及鍺陸續被發現,成就了他化學先知的地位。瑪里居禮也發現了釙和鐳。20世紀,最後一種天然元素─錸和第一個實驗室裡合成的人造元素─鎝相繼問世。科學家們藉著認識原子結構,終於明白元素週期表正是原子中電子組態的外顯。時至今日,元素依原子序排列,我們熟知的元素週期表上已有118個元素。門得列夫的洞見及創作,也是歷史上眾多化學家們合作與傳承而開展的化學革新。
「傳說到傳奇,原子真的存在嗎?」原子的概念從哲學觀點逐步變成人人確信的科學。西元前400多年,德莫克利特(Democritus)提出原子理論,認為物質是由無法再分割的粒子所組成。18世紀的法國化學家拉瓦節,做出了第一份現代元素表,徹底推翻四元素理論和燃素理論,說明燃燒反應就是物質和氧的化合。普魯斯特的定比定律、給呂薩克的氣體反應體積定律、道耳頓的倍比定律、亞佛加厥提出分子概念,門得列夫發表週期表,然而他們都不知原子的構造。
直到十九世紀末,倫琴在研究陰極射線管時發現X光。之後貝克勒發現鈾礦就算沒有照射陽光依然能讓底片感光。居禮夫婦發現鈾礦放射性的強度,只和鈾的量有關,和化學環境無關。他們認為放射性來自原子的內部,這也暗示原子不是最基本的粒子。發現X光的年代,湯姆森發現了電子。他建立梅子布丁原子模型。拉賽福在1908-1913年,用α粒子撞擊金箔片的實驗推翻布丁模型,證明了原子的質量集中在一個非常小帶正電的核心,而電子在核外環繞,於是提出行星原子模型。當人們知道原子裡面還有質子、中子,就衍伸出它們能否再繼續分割?後來發現質子、中子也不是最基本的粒子,而是由夸克構成。
宇宙生成30分鐘後,原子核僅含75%的氫和25%的氦。大約40萬年後,電子才與原子核形成中性的原子。2~3億年後,才有恆星產生。太陽內部進行核融合反應,4個質子融合成氦原子核、3個氦融合成碳原子核、碳和氦融合成氧原子核。質量大的恆星能形成鈉、鎂、矽、磷、硫、鈣、鐵、鎳等原子核,超新星爆炸才能產生比鐵重的元素;中子星之間的碰撞合併爆炸,則可以產生金、銀、鉑等等貴重元素。
主講之「從西伯利亞到聖彼得堡—門得列夫築夢週期表之路」。150年前排列出元素週期表的門得列夫,終其一生致力尋求科學在自然界中的規則與真理,使更多人能依循這份美麗的秩序而前進。門得列夫生於俄國西伯利亞,具有韃靼血統的母親帶著他與姊姊一路跋涉到莫斯科,再輾轉到聖彼得堡,讓門得列夫進入聖彼得堡大學中央教育學院就讀。取得碩士學位的門得列夫,步入教職及研究的工作,於1861年編寫了《有機化學》教科書,1868年發表《化學原理》第一卷。
這段期間,科學家們不斷透過實驗發現新元素並研究其性質。徳貝萊納(J. W. Dobereiner)提出「三元組」元素排列法後,「碲螺旋(telluric helix)」狀週期表、「八音律法(Law of Octaves)」相繼問世,但都沒有一個較宏觀的理論系統產生。門得列夫把每個元素與其原子量及化學性質寫在一張張卡片上,如此組起一副紙牌,經過耐心地紙牌排列,終於獲得元素週期表!門得列夫於1869年發表的元素週期律裡,依照原子量大小排列,其性質明顯呈現出週期性。週期表上有些未知的空格,門得列夫則大膽預期可能會有未知新元素。1875年「類鋁元素」鎵(Ga)被發現,門得列夫特別寫信給發現者德布瓦博德蘭(P. E. L. de Boisbaudran),說明鎵的比重值可能有誤。德布瓦博德蘭以更嚴謹的方式重新提煉純鎵並進行實驗,測得鎵的比重確實為門得列夫的預測值!這是人類首度以科學方法準確預言了未知元素的案例,使歐洲的科學界大為振奮。
1871年,門得列夫出版了《化學原理》第二卷,後續幾年中他所預測的未知元素也陸續被發現與證實,唯獨總是與諾貝爾獎擦身而過。1907年2月門得列夫因流感而病逝於聖彼得堡。美國科學家格倫西柏格博格(Glenn T. Seaborg)在1955年發現了原子序為101的新元素,特別於1963年將此元素命名為「鍆(Md)」,藉以表彰與紀念門得列夫的貢獻。
「為什麼週期表長這樣?—解析元素週期性背後的量子密碼」。門得列夫提出週期表的時代,把數百年的化學知識濃縮到一個表裡。現代的週期表,我們除了想問為什麼長這個樣子,也想知道元素的週期性從何而來?
電子必須用量子力學來描述其運動。德布羅依(de Broglie)在1924年提出電子的波動性學說,其波長和動量呈反比。1927年電子繞射實驗的結果證明電子有波動的性質。物質是波因而有著堅實的實驗證據。一維的駐波震動態可以用節點數區分,沒有節點的駐波叫做n=1的狀態,有1個節點就是n=2…… ,增加節點可以把穩定駐波態建構出來。從德布羅依的公式來看,n越大波的能量就越高。二維駐波看的是節線,三維則是看節面。
一個電子在原子核周圍的駐波態,最穩定的應該是一個沒有節面的球形。電子在空間中分布的狀態,最穩定的就是1s軌域。接著考慮加入球形節面,便可以建構出越來越大,能量也越來越高的2s, 3s,… 等其他s軌域。若從1s出發加入一個平面節面,則可以建構出p軌域,加入兩個平面節面則得到3d軌域。這些軌域在氫原子中能量相同。多電子原子跟氫原子不一樣之處就是電子自旋以及電子間的斥力。包立不相容原理認為自旋相同的電子不能填在同一個軌域。一個軌域最多填兩個電子,一個自旋向上,另一個向下。電子之間有排斥力,多電子原子的軌域能階為:s<p<d<f。
把電子填進軌域要從能量最低的地方開始填。氫只有1個電子,就會填到1s軌域。氦有兩個電子,會把1s軌域填滿。鋰有3個電子,會填到2s軌域。繼續下去,2p填完就填3s,進到下一個週期──這就是週期性的由來。再看門得列夫的週期表,如果我們把最外層的價電子組態一樣的排在同一行,就可以用價電子組態解釋原子的反應性、週期性和價數。
「瑪里居禮與放射性元素」歷史上改變了世紀的原子彈,近年熱烈討論的核能發電等,皆與核子科學密不可分。1895年底,侖琴偶然發現了X光的存在。短短一年間,科學界一片沉迷於新穎的X光研究。剛生完孩子的瑪里‧居禮反而選擇相對冷門的鈾作為她的博士論文主題。法國的貝克勒也從鈾發現其擁有相似於X光的天然放射性。透過皮耶‧居禮與其兄弟擁有之壓電設備,瑪里‧居禮將鈾化合物放置其中,即產生能夠量測之電流。他們三人共同分享1903年的諾貝爾物理獎。從此放射性(Radioactivity)這個名詞被創造出來,放射性元素的時代由此開展。
研究鈾的同時,瑪里‧居禮也向奧地利鈾礦公司取得提煉鈾之後的殘渣,並測量這些殘渣的放射性。她發現這些殘渣中的放射性遠比鈾還要強。殘渣中極可能有別種放射性元素的存在。經過多年努力的化學分離,瑪里‧居禮成功在1907年成功分離出鐳(Ra)和釙(Po),獨獲1911年的諾貝爾化學獎。
瑪里‧居禮奠定了核子科學的基礎。1930年代,中子的發現開啟了人工放射線研究嶄新的一頁。第一個人工放射線研究,就是由瑪里‧居禮的大女兒(伊雷娜,(Irene Joliot-Curie)和女婿弗雷德里克·約里奧(Jean Frederic Joliot)發現的。核子科學中的影響人類歷史的重大研究──核蛻變(Nuclear transmutation)也在此時被提出。核分裂很快就在1938年被發現。當鈾235以中子撞擊,核分裂會發生,顯示「連鎖反應」的潛在可能與巨大能量產生的可能。人類史上數一數二龐大的曼哈頓計畫就此展開,短短6年的時間,原子彈被製造出來,成為經歷過二戰的人們無法抹滅的記憶。
瑪里‧居禮對於世界的貢獻,不僅限於開拓核子科學新領域。她的小女兒伊芙(Eve Curie),雖未如大女兒伊雷娜涉足科學領域,但因著提筆寫下其母一生的傳奇故事,描寫她一生的書本、電影甚至舞臺劇至今依然廣傳於世。
的「翻轉週期表的西博格與人造超鈾元素」。近代核化學與合成元素的巨擘格倫 . 西博格(Glenn T. Seaborg)。在 1937 年完成他的博士學位,當時週期表上較輕的元素大多已被尋獲,更重的元素半衰期極短,在地球的環境沒有辦法穩定存在。特別是超鈾元素(transuranium elements),泛指原子序大於 92 的元素,幾乎都必須仰賴人工合成。關鍵科技就是加速器。
西博格在加州大學柏克萊分校時,勞倫斯(E. Lawrence) 設計的迴旋加速器正邁向成熟。西博格也乘著天時地利,躋身為應用加速器於化學問題的先驅。粒子加速器合成元素的原理在於加速粒子撞擊特定的原子靶,使較輕的原子核在高能量與其他適當條件下和其他原子核完成融合。原理看似簡單,但分析實驗產出、演繹結論與驗證結果,每一步需要超群的化學洞見與嚴格的科學紀律。
初出茅廬的西博格在擔任博士後研究員的前兩年便合成出鐵跟碘的同位素,兩者後來都有實際的醫療價值。1940 年代,奠基於合成錼(neputonium)的研究,西博格發現了原子序 94 的鈽-239(plutonium-239)。在爾後的二十年間,作為主要領導者合成鋂(Americium)、鋦(Curium)、鉳(berkelium)等錒系元素,並參與了鉲(californium)、鑀(einsteinium)等六個超鈾元素的發現。其中包括以他自己名字命名的金喜(seaborgium)— 該元素的命名也打破當時不以還在世的人物命名的慣例,他和 E. McMillan 最終在1951 年獲頒諾貝爾化學獎。
面對這些新的超鈾元素,儘管最簡單的主意是將它們依序塞進過渡金屬,在通過後續實驗測試化學性質、並參考前一週期的鑭系特性,以西博格為首的一群化學家提出錒系理論,說明在該週期有一行元素性質都與錒相近。週期表現在停在了原子序 118,但回顧科學史,我想我們有理由期待,這不會是週期表的盡頭。
由講座顧問蔡蘊明教授主講「隱身的忍者—貴族和它們的產處」。鈍氣是位於週期表第18族的元素「氦氖氬氪氙氡」。門得列夫最早提出週期表的時代,科學家對此族元素是一無所知。蔡蘊明教授帶著聽眾回溯時光,從早期對空氣的研究開始。1888年雷立爵士(Lord Rayleigh)對空氣組成的研究出現理論無法解釋的實驗誤差。當時已知空氣主要由氧氣和氮氣組成,而雷立爵士測量氮氣的分子量時,為確認結果的可信度,選擇從兩種不同方法製備氮氣,卻發現無論他怎麼小心控制實驗程序,從空氣中取得的氮氣和從氨中取得的氮氣,分子量計算結果一直有無法解釋的差距。
1893年化學家拉姆齊回應雷立爵士的研究結果,兩人猜想空氣中可能存有一種不易反應的未知氣體。拉姆齊在隔年成功分離該未知氣體,藉由元素光譜和難以與其他物質反應的獨特性質等證據,證明了氬的存在。然而雷立爵士與拉姆齊進一步基於氣體動力論、預測氬氣可能為單原子氣體時,因直接挑戰當時週期表分類的完整性,受到門得列夫等知名化學家的強烈抨擊,雷立爵士決心專注在物理學研究,拉姆齊則繼續尋找忍者家族成員的旅程。
1895年拉姆齊將他用三先令六便士購買的稀土鈾礦放在硫酸溶液中加熱,發現氦氣。1898 年仰賴液化空氣技術的進展和助手的協助,氪、氙、氖等單原子氣體一個個在一星期的蒸餾過程現身。原子量最大的氡則是化學家索迪(Frederick Soddy)與拉姆齊合作,收集鐳放射的氣體而得到。1904年門德列夫終於在新修正的週期表加入這個忍者家族,雷立爵士和拉姆齊兩人也在該年分別榮獲諾貝爾物理獎與化學獎。
蔡蘊明教授在演講尾聲時說:「尋找真理的科學並不是一條平坦的大道,但是請相信我,裡面充滿了樂趣。」
講】由優勝奈米科技許景翔總經理講「為什麼稀貴金屬這麼重要?」本單元透過稀貴金屬發現的歷史、科技應用、環境安全、綠色化學,讓大家了解8個貴金屬與17個稀土金屬的重要性,並共同在綠色化學的概念下,更重視環保科技,愛惜地球資源。
八大貴金屬中,除了熟知的金、銀之外,還包含了鉑系金屬的釕、銠、鈀、鋨、銥、鉑。貴金屬的發現最早可溯及距今8000多年前出現在埃及以及保加利亞等文明的金,和6000年前發現的銀。鉑系金屬則大約於距今270年前才陸續被發現。稀土元素並不稀少。鑭系金屬有鑭、鈰、鐠、釹、鉕、釤、銪、釓、鋱、鏑、鈥、鉺、銩、鐿、鎦以及兩個過渡金屬釔和鈧所組成。最早的稀土金數在200年前左右被發現,而鉕則是美國科學家藉核反應才找到的人造元素。
八大貴金屬中銀的產量最高,其蘊藏量被認為在未來一百年中就會用盡。稀土金屬因分布不均讓開採困難。除了用盡的危機,提煉這些金屬的過程大多也需要使用高腐蝕性的溶液來進行。從這些省思導致「城市礦山」的概念,近年全球許多企業也嘗試加入循環經濟的概念在發展中。1998年,「綠色化學」的概念興起,許總經理率領團隊開發了「環保剝金術」,能夠高選擇性地從3C產品回收「金」,並做其他利用。
第九講】元素週期表150周年探索系列講座的最後一講由年輕化學家戴桓青教授主講「煉金術跟你想得不一樣-連牛頓也瘋狂的古代化學」。分析過往不被人們瞭解、誤解重重的煉金術。戴教授跟「煉金術」結緣的開端來自與臺灣奇美博物館合作的義大利名琴研究,他生動描繪煉金術的價值與意義。歷史上的化學史可以用西元1650年來區分,之前為鍊金術時代,之後則進入現代化學。古代的鍊金術就是「古代的化學」,既不是魔術也不是騙術。鍊金術與現今化學一脈相承,述說著化學技術的開發史。
大多數人都聽過牛頓(Sir Isaac Newton)發現萬有引力、三大運動定律、微積分以及光粒子理論。近20年才注意到他也是鍊金術士。牛頓在皇家造幣局待了26年,從事造幣工作,分析了各國金幣銀幣的純度,成功起訴了偽造幣者。作為分析化學的高手,牛頓的貨幣分析報告是全歐洲最完善的。但是仍然追求神秘的鍊金術,留下大批實驗手稿。
史特底瓦里與瓜奈里名琴的秘密可以窺見鍊金術的奧妙與價值。現今許多小提琴大師都只拉史特底瓦里名琴與瓜奈里名琴,因為能產生最甜美的樂音。這些名琴的製琴師都是在義大利的克里蒙納學習、成長,這個祕密塵封了幾百年,根據戴教授最近的研究認為這些名琴不是用天然木材,而是添加了許多礦物配方加工處理。化學處理、老化與震動的交互作用創造出名琴的特性。這是與鍊金術完美結合的成功案例。
參考資料
https://youtu.be/kDP6rCRyeyI
2. https://youtu.be/c0JUC12pFs8
3. https://youtu.be/mhtYKneJNcw
4. https://youtu.be/_T0m1Hp9iuI
5. https://youtu.be/KAtPVONxTjk
6. https://youtu.be/rLXKPloqRvc
7. https://youtu.be/9aznrFgap10
8. https://youtu.be/jTVUYZuGr2s