淺談道爾頓的原子學說 / 胡景瀚
淺談道爾頓的原子學說
胡景瀚
國立彰化師範大學化學系
[email protected]
n定比定律、分壓定律和倍比定律
1799普魯斯特(Joseph Louis Proust, 1754-1826)提出了「定比定律」(law of definite proportions),定比定律的內容是:
化合物的組成元素的質量比為定值。
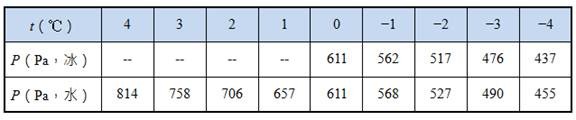
道爾頓(John Dalton, 1766-1844)(見圖一)在十九世紀初(1801年)發表了「分壓定律」(law of partial pressures):
氣體混合物的總壓力等於組成氣體的分壓的和。
1804年,他又發表了「倍比定律」(law of multiple proportions),倍比定律的內容是:
如果兩元素可以形成不只一種化合物,化合物中相對於等重的第一種元素,另一種元素的質量成簡單整數比。
道爾頓
(圖片來源:https://en.wikipedia.org/wiki/John_Dalton)
同一時期,道爾頓研究了多種氣體在水中的溶解度,他對於不同的氣體在水中有不同的溶解度這個事實感到相當困惑。道爾頓的解釋是,不同的氣體各有不同的「最終粒子」(ultimate particles),粒子的質量和複雜度越大,在水中的溶解度就越大,這個解釋也是道爾頓原子學說的起點。[1]
道爾頓的想法,從比較物理觀點的粒子理論(氣體混合、氣體溶解度),逐漸演化成化學觀點的原子學說,描述分子的原子組成及化學反應。這一段思想轉化的過程是許多科學家和科學史家非常感興趣的。
道爾頓認為水由1個氧原子和1個氫原子組成,氨由1個氮原子和1個氫原子組成,根據水的氧和氫的質量百分比,以及氨中氮和氫的質量百分比,以當時的實驗數據,氫、氮和氧原子相對於氫原子的質量比為1 : 4.2 : 5.5。[2] 將三種氮的氧化物中氧的相對質量列出(以氮為4.2,分子式列於括號供參考,如表一所示:
表一:道爾頓認為三種氮的氧化物中氧的相對質量
|
|
N |
: |
O |
|
nitrous oxide (N2O) |
4.2 |
: |
2.4 |
|
|
4.2 + 4.2 |
: |
4.8 |
|
nitrous gas (NO) |
4.2 |
: |
5.7 |
|
nitric acid (NO2) |
4.2 |
: |
9.9 (= 5.0 + 5.0) |
道爾頓的想法是,若將上表的三個化合物視為2個氮原子和1個氧原子(N2O),1個氮原子和1個氧原子(NO)和1個氮原子和2個氧原子(NO2)的化合物(這些猜測是正確的),則氧的相對質量為4.8, 5.7和5.0,大約等於5.2。如果將5.2和5.5的差異視為可接受的誤差,關於前述三種氮的氧化物的原子組成的猜測應該是正確的。
n道爾頓的原子學說
1808年,道爾頓發表了《化學哲學的新系統》(A New System of Chemical Philosophy)的第一冊,書中他描述了他的原子學說。簡要地說,道爾頓的原子學說內容是:
各種元素由其特定的、完全相同的且不可分割的原子所組成,化合物由原子組成,原子的組成數目固定,化學反應是化合物原子的分裂及重新排列。
貝托萊(Claude Louis Berthollet, 1748-1822)不接受普魯斯特的定比定律,他認為化合物中的元素相對質量有無窮多種可能,元素的質量比和參與反應的元素質量及反應方式有關。他舉了幾個實例來支持他的想法,例如金屬氧化物的含氧量會隨著溫度上升而增加,[3] 合金可以有任意質量比等等。貝托萊和普魯斯特爭論了數年,道爾頓的原子學說成功地消弭了這個爭端。
原子假說可以協助我們確認化合物的組成,以及依據實驗數據訂定原子的相對質量。在化學中,很重要的一項任務就是決定粒子的相對質量。不過物質中粒子的相對質量常常必須從另一物質中他們的相對質量推測而得,並根據後續的研究結果而更正。道爾頓認為他找到一個方法,這個方法可以確定「基本粒子」(elementary particle)及「化合粒子」(compound particle)的相對質量,這個方法的首要之務就是決定化合物的化合規則,知道化合粒子中基本粒子的數目。他的規則如下:
如果有兩種「原子」A和B(原文:two bodies, A and B),其可能之結合有:
1原子A+1原子B=1原子之C,二元化合物(binary)
1原子A+2原子B=1原子之C,三元化合物(ternary)
2原子A+1原子B=1原子之C,三元化合物(ternary)
1原子A+3原子B=1原子之C,四元化合物(quarternary)
3原子A+1原子B=1原子之C,四元化合物(quarternary)
原子化合的一般法則為:
1.當原子只有1種組合方式時,產物一定是二元化合物,除非有其他理由。
2.有2種組合方式時,產物一定是二元和三元化合物。
3.有3種組合方式時,產物一定是1個二元和2個三元化合物。
4.有4種組合方式時,產物一定是1個二元,和2個三元化合物和1個四元化合物,依此類推。
5.二元化合物的密度應比2種原子的混合物大。
6.三元化合物的密度應比組成它的二元化合物和原子的混合物大,依此類推。
從這些規則及實驗數據,道爾頓推論水是由氫和氧組成的二元化合物,兩個基本原子的質量比接近1比7(質量相對於氫氣)。其次,氨是由氫和氮組成的二元化合物,兩個基本原子的質量比是1比5。還有氮的氧化物的組成:他認為一氧化氮(nitrous gas)是由氮和氧組成的二元化合物,兩個基本原子的質量比是5比7,二氧化氮(nitric acid)是由1個氮和2個氧組成的二元或三元化合物,其質量是19。一氧化二氮(nitrous oxide)是由2個氮和1個氧組成的三元化合物,其質量是17。三氧化二氮(nitrous acid)是由1個二氧化氮和1個一氧化氮組成的二元化合物(在道爾頓所繪的化合原子中被歸在五元化合物),其質量是31。三氧化氮(oxynitric acid)是由1個二氧化氮和1個氧組成的二元化合物,其質量是26。最後是碳的氧化物,道爾頓推測一氧化碳(carbonic oxide)是由碳和氧組成的二元化合物,其質量是12。二氧化碳(carbonic acid)是由1個碳和2個氧組成的三元化合物(也可以是一氧化碳和氧的二元化合物),其質量是19。
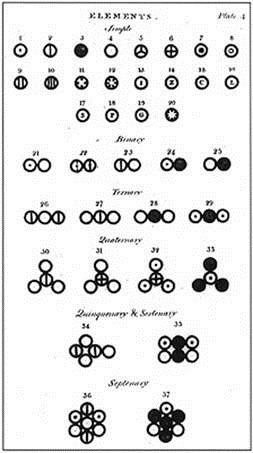
n道爾頓的原子圖形符號
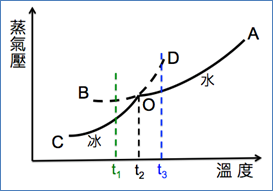
道爾頓以圓圈圖案代表各種基本原子,例如黑圓代表碳,空心圓代表氧等。二元化合物以2個相鄰的圓表示,三元化合物以成一直線的3個相鄰的圓表示,四元化合物為一圍繞中心原子的平面三角形。道爾頓認為相同原子彼此互斥,因此在排列時彼此盡量遠離。道爾頓的原子質量表及其符號列於表一,他所繪的原子符號列於圖二。
圖二:道爾頓的原子圖形符號
(圖片來源:https://en.wikipedia.org/wiki/John_Dalton)
道爾頓指出,物質分為氣體(原文為「彈性流體」elastic fluids)、液體和固體等三類,水是一種可能具有這三種型態的物質。氣態的物質中,數量非常多的粒子彼此間的距離遠大於液態和固態。不論粒子聚合或分離,這些粒子不會憑空產生或消滅,我們只能將粒子分離或聚合以改變他們的狀態。物質由極小的粒子,也就是「最終粒子」所組成,這些最終粒子無論質量或形狀都是完全相同的。最終粒子間或大或小的吸引力造成了物質的三種型態。
n道爾頓認為粒子之間的排斥力為「熱質」
除了吸引力,道爾頓認為另外有一個最終粒子之間重要的作用力,也就是「排斥力(force of repulsion)」,他認為排斥力是由「熱質(heat, caloric)」[4] 造成的。「熱質」這種流體圍繞著所有物質的最終粒子,熱質粒子互相排斥,而為最終粒子所吸引。當粒子[5] 流失熱時,熱質的體積減小,粒子間排斥力減少彼此靠近,例如水蒸氣變成水。物質的氣態、液態和固態是最終粒子之間互相衝突的吸引力和排斥力調節的結果。
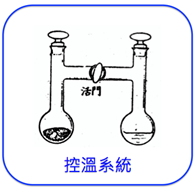
圖三是道爾頓所繪的氣體原子及外圍熱質的圖形,我們可以看出氣體的體積包括原子的核心部分和圍繞於外的熱質,原子和原子以熱質為界。[6] 道爾頓假設不同粒子對熱質的吸引強度不同,吸引力強的粒子其熱質體積收縮,體積因而減少,反之吸引力弱的粒子體積增加。圖三的缺點,是將氣體描繪成靜態的整齊排列,還造成了粒子間的距離相當於粒子大小的錯覺。道爾頓的想法也讓他難以接受「相同體積含有相同的各種粒子數」的觀念。
hydrogen gas nitrous gas carbonic acid
圖三:道爾頓的原子及外圍熱質的圖形,由左至右為氫氣(hydrogen gas)、一氧化氮(nitrous gas)及二氧化碳(carbonic gas)
(圖片來源:https://commons.wikimedia.org/wiki/File:1911_Britannica_-_Atom_-_Dalton.png)
n道爾頓使用「原子」一詞
道爾頓使用了「原子」(atom)一詞來代表「最終粒子」、「不可分割的粒子」,即組成元素或化合物的最小粒子,這個粒子不能被分割,也不能被轉變成其他粒子。道爾頓的相關文字的翻譯及原文如下:
”carbonic acid)的最終粒子為化合原子。雖然這個原子可以再被分解,被分解的二氧化碳成為碳和氧,不再是二氧化碳了。
Matter, though divisible in an extreme degree, is nevertheless not infinitely divisible. That is, there must be some point beyond which we cannot go in the division of matter. The existence of these ultimate particles of matter can scarcely be doubted, though they are probably much too small ever to be exhibited by microscopic improvements. I have chosen the word atom to signify these ultimate particles, in preference to particle, molecule, or any other diminutive term, because I conceive it is much more expressive; it includes the notion of indivisible, which the other terms do not. It may be said that I extend the application of it too far, when I speak of compound atoms; for instance, I call an ultimate particle of carbonic acid a compound atom. Now, though this atom may be divided, yet it ceases to be carbonic acid, being resolved by such division into charcoal and oxygen.
從這段話我們可以看出,道爾頓所稱的「原子」[7] 和「化合原子」分別指的是「元素的自然狀態的最終粒子」和「化合物的最終粒子」。氧「原子」是現代化學的氧分子,二氧化碳「原子」是現代化學的二氧化碳分子。例如,在道爾頓提出的原子質量表中,水被稱為「一個水原子」(an atom of water)。
道爾頓將「原子」一詞推向化學的核心,不過他所謂的原子和現代的原子在內涵上有一段距離。根據同原子互斥的原則,他認為所有氣體元素都是單原子。又根據他的化合法則1,他認為氮和水是HN和HO(當時水是唯一已知的氫和氧的化合物)。依後見之明,如果我們使用正確的質量百分比,以現代準確的原子量來看,氫、氮及氧原子相對於氫原子的質量比為1 : 4.7 : 8。N2O、NO、NO2的質量比(以氮為4.7),如表二所示:
表二:依後見之明,N2O、NO、NO2的質量比
|
|
N |
: |
O |
|
nitrous oxide (N2O) |
4.7 |
: |
2.7 |
|
|
4.7 + 4.7 |
: |
5.4 |
|
nitrous gas (NO) |
4.7 |
: |
5.4 |
|
nitric acid (NO2) |
4.7 |
: |
10.7 (= 5.4 + 5.4) |
氮和氧的質量比為4.7 : 5.4,相對於4.7 : 8,差異非常大。
氧質量比。關於原子質量的確認,錯誤的分子組成及不準確的實驗數據造成了科學界數十年的混亂局面。[8] 表三為道爾頓的原子質量表(相對於氫氣)。
表三:道爾頓的原子質量表(相對於氫氣),分子式為本文作者所加,原子圖形見圖二。
|
|
原子名稱 |
現代中文名稱 |
原子質量 |
|
簡單原子(simple) |
|||
|
1 |
hydrogen |
氫 |
1 |
|
2 |
azote |
氮 |
5 |
|
3 |
carbon/charcoal |
碳 |
5 |
|
4 |
oxygen |
氧 |
7 |
|
5 |
phosphorous |
磷 |
9 |
|
6 |
sulphur |
硫 |
13 |
|
7 |
magnesia |
鎂 |
20 |
|
8 |
lime |
鈣 |
23 |
|
9 |
soda |
鈉 |
28 |
|
10 |
potash |
鉀 |
42 |
|
11 |
stronites |
鍶 |
46 |
|
12 |
barytes |
鋇 |
68 |
|
13 |
iron |
鐵 |
38 |
|
14 |
zinc |
鋅 |
56 |
|
15 |
copper |
銅 |
56 |
|
16 |
lead |
鉛 |
95 |
|
17 |
silver |
銀 |
100 |
|
18 |
platina |
鉑 |
100 |
|
19 |
gold |
金 |
140 |
|
20 |
mercury |
汞 |
167 |
|
二元原子(binary) |
|||
|
21 |
water |
水HO |
8 |
|
22 |
ammonia |
氨HN |
6 |
|
23 |
nitrous gas |
一氧化氮NO |
12 |
|
24 |
olefiant gas |
乙烯HC |
6 |
|
25 |
carbonic oxide |
一氧化碳OC |
12 |
|
三元原子(ternary) |
|||
|
26 |
nitrous oxide |
一氧化二氮NON |
17 |
|
27 |
nitric acid |
二氧化氮ONO |
19 |
|
28 |
carbonic acid |
二氧化碳OCO |
19 |
|
29 |
carbureted hydrogen |
甲烷HCH |
7 |
|
四元原子(quarternary) |
|||
|
30 |
oxynitric acid |
三氧化氮NO3 |
26 |
|
31 |
sulphuric acid |
三氧化硫SO3 |
34 |
|
32 |
sulphuretted hydrogen |
硫化氫SH3 |
16 |
|
33 |
alcohol |
酒精C3H |
16 |
|
五元及六元原子(quintenary and hexenary) |
|||
|
34 |
nitrous acid |
三氧化二氮N2O3 |
31 |
|
35 |
acetous acid |
醋酸H2C2O2 |
26 |
|
七元原子(septenary) |
|||
|
36 |
nitrate of ammonia |
硝酸銨(NH2)NO3 |
33 |
|
37 |
sugar |
糖C3H+CO2 |
35 |
n附註
道爾頓畢生都對氣象觀察有極高的興趣,他對氣體的混合和氣體溶解度的研究都和他對氣象學的興趣有關。
這個數據來自道爾頓1803年的文章,幾年後(1808年)改為1 : 5 : 7。
我們現在知道這是因為隨著溫度上升,金屬的不同氧化物混合的比例會有變化。
在道爾頓的年代,「燃素說」逐漸被揚棄,「熱質說」逐漸興起。熱質被假設為一種和熱能有關的,沒有質量的流體。
道爾頓並未使用「分子」一詞,雖然他知道他的同期科學家使用這個字。在此「粒子」比較像現代的分子。
注意三張圖的比例不同,我們可以約略看出相同體積的氫氣數目較其它氣體多。
道爾頓也稱之為「基本原子」(elementary atom)或「基本粒子」(elementary particle)。
又例如,道爾頓認為氨是HN,乙烯是HC,所以質量都是6 (= 5 + 1)。如果實驗的準確度提高的話,氨中氮和氫的質量比是 4.67 : 1,乙烯中碳和氫的質量比是 6 : 1 ,如果依此數據則道爾頓將認為他得到相對於氫氣質量的氮和碳的質量是4.67和6,但是這又和從一氧化氮和一氧化碳得到的氮和碳相對於氫氣的質量不相同(7和6)。
n參考文獻
John Dalton, Memoirs of the Literary and Philosophical Society of Manchester, Second Series, 1, 271-87 (1805).
John Dalton, A New System of Chemical Philosophy. Manchester, 1808.
Roman Mierzecki, Journal of Chemical Education, 58, 1006 (1981).
Christopher S.W. Koehler, Chemistry Chronicles, 51 (2003).