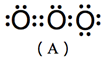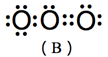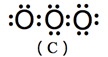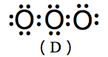臺灣化學教育
Chemistry Education in Taiwan疑難問題集錦之一:
有關離子安定性和分子偶極的問題
施建輝
國立新竹科學園區實驗高級中學
教育部高中化學學科中心
schemistry0120@gmail.com
n 疑難問題一:為何離子的安定性Pb2+ > Pb4+ 而Sn4+ > Sn2+?
前言
《普通高級中學課程暫行綱要》(95暫綱)高中二下金屬元素之「錫、鉛及其化合物」這一小節,有一段文字:「錫與鉛的氧化態有+2和+4,其中Sn4+比較安定,因此Sn2+在氧化還原反應中提供電子,自身形成Sn4+,此處Sn2+做為還原劑;反之,Pb2+比較安定,所以Pb4+在氧化還原反應中得到電子,自身形成Pb2+,此處Pb4+做為氧化劑」。這段文字經常被學生詢問:「為什麼?」,大多數高中化學教師也覺得困惑,不知如何解釋清楚這段文字。此篇文章提供「惰性電子對效應」(The Inert-Pair Effect)的說法,可幫助教師向學生們解釋這段文字。
惰性電子對效應
「惰性電子對效應」是英國化學家N. V. Sidgwick(1873~1952)為了解釋ⅢA族(13族)、ⅣA族(14族)與ⅤA族(15族)某些元素的穩定氧化態與族數不一致而提出的說法。以ⅢA族(13族)為例,B2O3之硼的氧化態為+3,鋁離子為Al3+,其氧化態亦為+3,兩者皆與其族數同,但同族位於下方的鎵有Ga3+、Ga+、銦有In3+、In+、以及鉈有Tl3+、Tl+,此三個元素皆存在兩種氧化態,共同的特點是後者的氧化態的價數比其族數少2單位。這種離子之氧化態較其族數少兩個單位的趨勢稱為「惰性電子對效應」。
另一個「惰性電子對效應」的例子為ⅣA族(14族),將金屬錫在空氣中燃燒,生成的產物為氧化錫(SnO2),其中錫為+4價,但是原子序較大的金屬鉛只失去其2個p軌域的電子而生成氧化鉛(PbO),其中鉛為+2價。N. V. Sidgwick認為這個現象是因為這些族愈往下面的週期,其價軌域中s軌域與p軌域能量差距愈大。這是因為s軌域上的電子有較好的穿透性(penetration),且內層d軌域的電子對s軌域上的電子的遮蔽能力(shielding ability)較低,因此位於價軌域的s軌域比起p軌域能量明顯低甚多,使得s軌域的2個電子傾向於留在原子內而不游離,這就是「惰性」與「電子對」兩個名稱的由來。同樣地,為何ⅣA族(14族)錫與鉛這兩種金屬在空氣中燃燒時,位於第五週期的金屬錫易於失去4個價電子而以+4價的Sn4+存在,位於第六週期的金屬鉛則易於失去2個價電子而以+2價的Pb2+存在,就能獲得令人滿意的解釋。最後附上N. V .Sidgwick所提出之「惰性電子對效應」英文原文:「The inert-pair effect is the tendency to form ions two units lower in charge than expected from the group number; it is most pronounced for heavy elements in the p block.」。
有效核電荷
以下以有效核電荷(effective nuclear charge,Zeff)來解釋「惰性電子對效應」。除了上述s軌域的電子有較好的穿透性,使s軌域能量較p軌域能量低甚多,以致p軌域上的電子比s軌域的電子容易失去之外,也可以有效核電荷這個概念來說明。影響s軌域電子惰性的主要因素是原子核對s軌域電子的引力大小,這種引力的大小決定於電子距原子核的遠近與有效核電荷,由於鑭系收縮(lanthanide contraction)的緣故,使得第六週期的原子半徑與同族第五週期的元素相近,因此影響引力大小的因素就由有效核電荷大小來決定。表1是ⅢA族(13族)、ⅣA族(14族)與ⅤA族(15族)從第四週期到第六週期的元素原子核對其ns軌域上的電子呈現的有效核電荷大小。
表1:ⅢA族(13族)、ⅣA族(14族)與ⅤA族(15族)某些離子的有效核電荷
|
ns2 |
ⅢA |
Zeff |
ⅣA |
Zeff |
ⅤA |
Zeff |
|
4s2 |
Ga+ |
7.95 |
Ge2+ |
8.95 |
As3+ |
9.95 |
|
5s2 |
In+ |
8.35 |
Sn2+ |
9.35 |
Sb3+ |
10.35 |
|
6s2 |
Tl+ |
10.51 |
Pb2+ |
11.51 |
Bi3+ |
12.51 |
以表1中ⅢA族(13族)為例,Ga的價軌域電子組態為4s24p1,故Ga+的價軌域電子組態為4s2,有效核電荷(Zeff)表示此時原子核對4s軌域上的電子的作用力,其它依此類推。表中各族元素,於第六週期的有效核電荷明顯增大甚多,也就是表示該元素之原子核對該軌域上的電子有特別大的束縛力,這就是為何6s軌域上的電子有特別大的惰性。由此可說明為何ⅢA族(13族)、ⅣA族(14族)與ⅤA族(15族)之第六週期離子的安定性:Tl+ > Tl3+、Pb2+ > Pb4+、Bi3+ > Bi5+。
延伸教學說明
在參考資料1(列在最後)中有提到:在溶解度規則表中,三種陰離子(Cl−、Br−、I−)會與五種陽離子(Ag+、Pb2+、Hg22+、Cu+、Tl+)等生成沉澱。根據「惰性電子對效應」,教師可以清楚向學生說明金屬鉈為何以一價的亞鉈離子(Tl+)存在。
在參考資料2(列在最後)中有提到:化學家經由實驗結果知道鉛離子的安定性Pb2+ > Pb4+,就利用這種特性設計出一個至今仍在使用的蓄電池:鉛酸電池。在鉛酸電池中,陽極是鉛(Pb),陰極是二氧化鉛(PbO2),電解液是硫酸,放電時,陽極的鉛氧化並與電解液中的硫酸根生成硫酸鉛(PbSO4),陰極的二氧化鉛中安定性較低的四價鉛(Pb4+)則還原並與電解液中的硫酸根生成硫酸鉛(PbSO4),請注意,陰陽兩極都是生成穩定的二價鉛離子。充電時,再利用電能將二價鉛離子分別變回原來的金屬鉛與二氧化鉛。
n 疑難問題二:如何解釋臭氧分子(O3)具有分子偶極?
前言
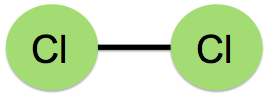
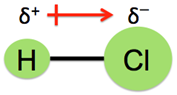
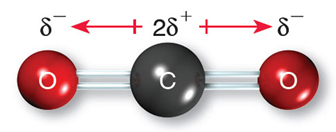
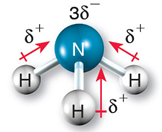
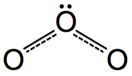
在分子偶極的試題裡,時常有一題造成教師與學生們困擾的問題:「臭氧分子到底有沒有極性?」。以分子極性的教學而言,教師們都會先介紹鍵偶極,敘述如下:由相同原子形成的共價鍵沒有鍵偶極,以Cl2為例,如圖1(左)所示,由不同原子形成的共價鍵則有鍵偶極,以HCl為例,其鍵偶極以向量表示,方向由帶部分正電荷(δ+)之氫原子的一端指向部分負電荷(δ−)之氯原子的一端,向量長短則表示鍵偶極的大小,如圖1(右)所示。接著介紹分子偶極:將鍵偶極以向量和的方式處理,若向量和為零,表示此分子之分子偶極矩為零,屬於非極性分子,圖2(左)為CO2分子,其鍵偶極的向量和為零,因此CO2分子為非極性分子;若向量和不為零,表示此分子具有分子偶極矩,屬於極性分子,圖2(右)為NH3分子,其鍵偶極的向量和不為零,因此NH3分子為極性分子。問題來了,臭氧分子形狀如圖3所示,其中兩個共價鍵都是由氧原子結合而成,依鍵偶極的定義,這兩個共價鍵應該都不具鍵偶極,因此臭氧分子也應該不是極性分子,但是正確答案都將臭氧分子列為極性分子之一,而解答的解析都是一句話帶過:「臭氧分子是唯一的例外」。學生對化學這個學科的抱怨,最主要的原因是有太多的例外,教師若不能說清楚,只好要學生「背下來」,這就難怪學生會覺得化學無趣。有沒有辦法清楚說明臭氧分子為何具有分子電偶矩?請往下看。
圖1:非極性共價鍵(左)和極性共價鍵(右)
圖2:CO2為非極性分子(左)和NH3為極性分子(右)
(圖片來源:選修化學上,翰林出版社)
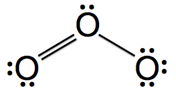
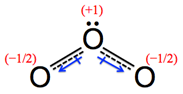
圖3:臭氧分子
臭氧分子為分子偶極矩的說明
臭氧分子為何具有分子偶極矩的說明如下:
(1) 臭氧分子結構見於圖3,但是其分子有四個共振結構,如圖4所示。
圖4:臭氧分子的共振結構
(A)、(B)兩共振結構中,氧原子皆符合八隅體法則(octet rule),屬於主要貢獻的結構,(C)、(D)兩共振結構中,存在不符合八隅體法則的氧原子,屬於不重要的結構。
(2) 因為位於中間的氧原子具有孤對電子,所以其分子形狀應該是折線形。因此,圖4之(A)、(B)兩共振結構之分子形狀可表示如圖5(A)、(B)所示,這兩個共振結構也可以圖5(C)的方式表示。
(A) (B) (C)
圖5:O3的共振結構示意圖
(3) 現在我們要計算圖5之臭氧分子中三個氧原子的形式電荷(formal charge, FC),以進一步了解臭氧分子中三個氧原子的電荷分布情形。形式電荷的計算式:![]()
(V為價電子數,N為未鍵結價電子數,B為鍵結價電子數),以圖5(A)臭氧分子為例,計算如下:
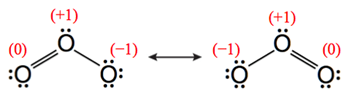
計算結果如圖6(A)所示,以同樣的方式計算圖5(B)臭氧分子,可得臭氧分子中三個氧原子的形式電荷分別為:−1、+1、0,如圖6(B)所示。
(A) (B) (C)
圖6:臭氧分子中三個氧原子的形式電荷
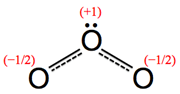
(4) 由於共振結構的緣故,圖6(C)左邊的氧原子應與右邊的氧原子有相同的形式電荷,因此這兩個氧原子的形式電荷都是![]() 。
。
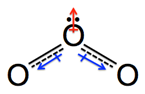
(5) 由形式電荷的計算結果可知,臭氧中的化學鍵電荷並非均勻分布在兩個氧原子上,因此並不適用前述「由相同原子形成的共價鍵沒有鍵偶極」的說法,其實中間的氧原子與左右兩個氧原子都具有一個鍵偶極,如圖7(A)藍色箭頭所示,這就可以解釋臭氧分子為何具有分子偶極矩。
圖7:臭氧分子的鍵偶極
(6) 再延伸一個鍵偶極的概念:若一個分子的中心原子存在孤對電子,則此孤對電子與中心原子也存在鍵偶極。因此,臭氧分子鍵偶極的正確表示法應如圖7(B)紅色箭頭所示。那藍色箭頭的向量和或不會正好與紅色箭頭抵消,使得臭氧分子還是不具有分子偶極矩,也就是臭氧分子應該是非極性分子呢?
(7) 筆者於Lange’s Handbook of Chemistry查到臭氧之分子偶極矩為0.534D,表示臭氧分子孤對電子形成的鍵偶極與兩個O−O的鍵偶極之向量和並不為零,由此可確認臭氧分子是一個具有分子偶極矩的極性分子。
n 參考資料
1. 劉新錦、朱亞先、高飛編著,無機元素化學(第二版,2010),科學出版社。
2. 選修化學(上),翰林出版社。
3. James G. Speight, Lange’s Handbook of Chemistry, Sixteenth Edition, McGraw-Hill.
想問一下,所以鍵偶極與形式電荷有關,也與電負性(EN)有關嗎?以一氧化碳作為例子,如果按形式電荷計算的話,碳是-1,氧是+1,可如果按電負性計算的話,氧應該是帶部分負電荷,而碳帶部分正電荷,這個情況又是怎樣?謝謝!