
臺灣化學教育
Chemistry Education in Taiwan
綠色化學創意競賽:
花蓮高工學生研究有效氯含量測定之藥品減量
陳怡真、賴惠敏、陳振信*
國立花蓮高級工業職業學校化工科
*asn970@gmail.com
n 教師指導心得
位於東部的國立花蓮高工,今年建校75週年;當年入列八大省立高工之一,如今學校各項績效與表現依然卓著。創校之初即設立的化工科,今年也將歡度75歲生日。化工科學生在校三年期間,在科內教師通力合作、妥善規劃與執行、嚴格督導與要求下,學生們不僅在專業技能指標之一的乙級化學技術士證照考取率上表現優異,另一項亦視為學生專業技能學習指標之一者為專題製作與小論文撰寫之能力表現。化工科學生自高二起,在科內教師指導下進行專題製作和小論文撰寫之練習,並參加各項校外相關競賽如中小學科學展覽、化工群科學校專題製作競賽、全國高中小論文比賽等活動,此等教學持續進行迄今,也在相關競賽中獲取無數佳績。
自去年六月獲知教育部公告第一屆綠色化學創意競賽活動計畫後,化工科內徵詢即將升上高三之化二學生意願後,自七月暑期開始在科內教師指導下進行資料蒐集、分組討論、題目確認、實驗設計與研究、數據整理、結果討論與分析等一系列工作。
我(通訊作者)在帶領學生進行上述活動過程中感觸最深的是,東部學生雖在學科基礎能力上不如西部,惟可塑性高,循循善誘並適時給與指引,學生們後續進步表現潛力無窮。這次與全國他校學生參與競賽之過程中,所累積經驗讓師生們再一次共同成長與進步,也再一次證明適性教育加上後天努力更能協助東部學生開創技職教育美好與亮麗的人生。
n 設計理念與探討
一、 得獎作品
l 作品名稱:漂白水中有效氯含量分析實驗藥品減量可能性之探討。
l 參賽學生:陳怡真、賴惠敏;指導教師:陳振信。
l 得獎名次:高工組綠色化學(減毒減量)創意競賽金牌獎。
二、 實驗動機與目的
對於現在環境的破壞,實驗時藥品減毒減量是必要的且勢在必行。然而,進行實驗時有些還是使用大量的藥品,為了達到綠色化學減量減廢的目的,我們選定了丙級化學技術士技能檢定術科檢定題目之一的「漂白水中有效氯之測定」作為這次專題的實驗題目。在高工一年級下學期練習此檢定實驗時,我們發現使用硫酸和碘化鉀的用量很多。以一間實驗室16人容量計算,每人每次實驗須耗用30 mL的2.0 M硫酸,一次實驗全部用量接近500 mL;而且2.0 M碘化鉀每人每次實驗耗用20 mL,一次實驗全部用量合計320 mL,碘化鉀價格昂貴,每次實驗所費不貲。在此實驗中,使用了大量的藥品來完成反應,我們想知道若這些藥品不大量使用是否可以完成良好的結果。因此,我們以平衡化學反應式來推算各反應物的莫耳數,以化學計量方式,計算其能完成反應的更低用量,接著我們試著逐漸降低藥品的用量,來確認是否可以完成正確無誤的實驗結果。
本實驗探討不同實驗變因(藥品用量)對實驗結果的影響,以達到減量的目標。探討的項目有二:(一)標定硫代硫酸鈉溶液的硫酸用量減少之可行性研究;(二)測定漂白水中有效氯的碘化鉀和硫酸用量減少之可行性研究。
三、 實驗原理
「漂白水中有效率之測定」實驗是利用碘間接滴定法,由於標準物碘酸鉀與適量的碘化鉀在酸性溶液(硫酸)中反應生成碘,而且碘可與硫代硫酸鈉進行氧化還原反應,以澱粉液為指示劑,因此可利用標準的碘酸鉀溶液來標定硫代硫酸鈉溶液,涉及的反應如式[1]~[2]所示,式[3]是 [1]~[2]的總反應。漂白水中的主要成分為次氯酸鈉,次氯酸鈉中的次氯酸根為強氧化劑,也可利用碘間接滴定法,以硫代硫酸鈉標準溶液來滴定,即可求得漂白水中有效率的含量,涉及的反應如式[4]~[5]所示,式[6]是式[4]~[5]的總反應。
IO3–(aq)+ 5I–(aq) + 6H+(aq) → 3I2(aq) + 3H2O(l) [1]
I2(aq) + 2S2O32–(aq) → 2I–(aq) + S4O62–(aq) [2]
IO3–(aq)+ 6S2O32–(aq) + 6H+(aq) → I–(aq) + 3S4O62–(aq) + 3H2O(l) [3]
OCl–(aq) + 2I–(aq) + 2H+(aq) → I2(aq) + Cl–(aq) + H2O(l) [4]
I2(aq) + 2S2O32–(aq) → 2I–(aq) + S4O62–(aq) [5]
OCl–(aq) + 2S2O32–(aq) + 2H+(aq) → Cl–(aq) + S4O62–(aq) + H2O(l) [6]
四、 實驗步驟
本實驗需用器材如圖一所示。
圖一:實驗實驗用器皿一景
實驗一:標定硫代硫酸鈉溶液/減少2.0 M硫酸用量之可行性研究
1. 配製碘酸鉀標準溶液:精秤0.5000 g乾燥的碘酸鉀,以蒸餾水溶解之,並以容量瓶定量至100.00 mL。[KIO3] = (0.5000 g / 214.0 g/mol) / 0. 1000 L = 0.2336 M
2. 取20.00 mL的碘酸鉀標準溶液,用蒸餾水稀釋至約50 mL。
3. 加入5.0 mL的2 M碘化鉀溶液。
4. 加入5.0 mL的2.0 M硫酸,分別將硫酸的用量降至3.0、1.0、0.50、0.10 mL。
5. 以硫代硫酸鈉溶液(配製0.10 M,未標定)滴定至淡黃色後,再加入澱粉指示劑1 mL,繼續滴定至藍色消失。
6. 重複標定,並計算硫代硫酸鈉溶液的標準濃度平均值。
實驗二:測定漂白水中有效氯含量/減少2.0 M碘化鉀溶液和2.0 M硫酸用量之可行性研究
1. 取2 mL漂白水,並精秤其重量,稀釋至體積50 mL。
2. 加入5.00 mL的2.0 M碘化鉀溶液,分別將碘化鉀溶液的用量降至4.00、3.00、2.00、1.00、0.50 mL。
3. 再加入10.0 mL的2.0 M硫酸,分別將硫酸用量降至8.0、6.0、4.0、2.0、1.0、0.50、0.40、0.25 mL。
4. 以硫代硫酸鈉標準溶液滴定直到淡黃色,再加入澱粉指示劑1 mL,繼續滴定直到藍色消失。
5. 重複滴定,並重複滴定,並計算漂白水中有效氯含量平均值。
五、 實驗結果和討論
實驗一:標定硫代硫酸鈉溶液/減少2.0 M硫酸用量
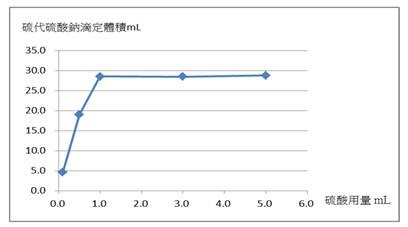
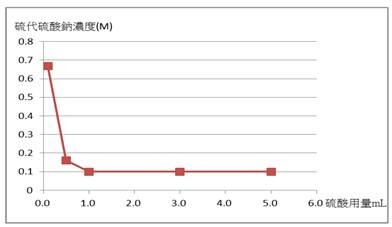
本實驗藥品用量為固定使用5.0 mL的2 M碘化鉀溶液並且減少2 M硫酸用量之實驗結果,如表一、圖二和圖三所示。
表一:2 M硫酸用量減少之實驗結果
|
硫酸用量(mL) |
5.0 |
3.0 |
1.0 |
0.50 |
0.10 |
|
硫代硫酸鈉溶液滴定體積(mL) |
28.75 |
28.45 |
28.50 |
19.00 |
4.60 |
|
硫代硫酸鈉溶液的真正濃度(M) |
0.0993 |
0.1004 |
0.1002 |
0.1617 |
0.6678 |
圖二:2 M硫酸用量減少,硫代硫酸鈉溶液的滴定體積(橫軸為硫酸用量,縱軸為硫代硫酸鈉溶液體積)
圖三:2 M硫酸用量減少,硫代硫酸鈉溶液的標定濃度(橫軸為硫酸用量,縱軸為硫代硫酸鈉溶液濃度)
添加2 M硫酸用量從5.0 mL減少至1.0 mL時,由圖三得知,硫代硫酸鈉標定的濃度接近0.1 M(平均值為1.000 M);若2 M硫酸用量降至0.5 mL,則會影響硫代硫酸鈉溶液的標定濃度。由實驗結果看來,推論在適當的硫酸用量下反應即可,我們發現使用體積1 mL的2 M硫酸就足以提供實驗所需酸性條件。透過平衡反應式[1]或[3],理論上,硫酸與碘酸鉀之莫耳數比為6:1。實際上,硫酸使用的莫耳數為10.0 × 10–3莫耳(5.0 mL × 2.0 M),碘酸鉀使用的莫耳數為0.467 × 10–3莫耳(20.00 mL × 0.02336 M),硫酸與碘酸鉀的莫耳數比為10.0:0.467 = 21.4:1.00,此比值高於6:1甚多,亦即硫酸為過量試劑,與理論相符合。
實驗二:測定漂白水中有效氯含量/減少2.0 M碘化鉀溶液和2.0 M硫酸用量之可行性研究
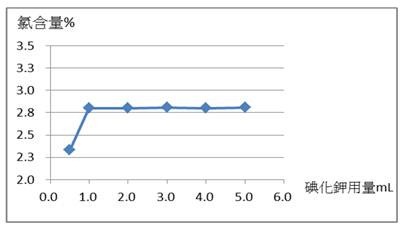
(一)本實驗藥品用量為固定使用5.0 mL的2 M硫酸並且減少2.0 M碘化鉀溶液用量之實驗結果,如表二和圖四所示。
表二:2.0 M碘化鉀用量與有效氯含量之實驗結果
|
碘化鉀溶液用量(mL) |
5.0 |
4.0 |
3.0 |
2.0 |
1.0 |
0.50 |
|
漂白水重(g) |
2.1382 |
2.1418 |
2.1591 |
2.1326 |
2.1488 |
2.1477 |
|
硫代硫酸鈉溶液滴定體積(mL) |
17.15 |
17.10 |
17.30 |
17.05 |
17.15 |
14.30 |
|
漂白水中有效氯含量(%) |
2.81 |
2.80 |
2.81 |
2.80 |
2.80 |
2.33 |
圖四:2.0 M碘化鉀用量與測定有效氯含量之實驗結果(橫軸為碘化鉀用量,縱軸為有效氯含量)
由圖四得知,添加2.0 M碘化鉀用量從5.0 mL減少至1.0 mL時,測得漂白水之有效氯含量皆接近2.80%,若2 M碘化鉀用量降至0.50 mL以下,則影響漂白水有效中氯含量的結果較多;推論碘化鉀溶液用量應適度過量方能提供反應所需,由實驗結果看來,我們發現碘化鉀的用量1.0 mL就足以提供實驗所需。透過平衡反應式[4],理論上,次氯酸鈉與碘化鉀的莫耳數比為1:2。實際上,次氯酸鈉計算的莫耳數為1.72 × 10–3莫耳(17.15 mL × 0.100 M),碘化鉀使用的莫耳數為2.0 × 10–3莫耳(1.0 mL × 2.0 M),得到次氯酸鈉與碘化鉀比為17.2:2.0,此比值高於1:2甚多,亦即碘化鉀為過量試劑,與理論相符合。
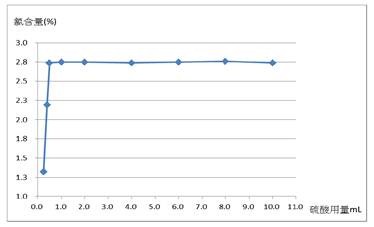
(二)本實驗藥品用量為固定使用5.0 mL的2.0 M 碘化鉀並且減少2.0 M硫酸用量之實驗結果,如表三和圖五所示。
表三:硫酸用量與有效氯含量之實驗結果
|
硫酸用量(mL) |
10.0 |
8.0 |
6.0 |
4.0 |
2.0 |
1.0 |
0.50 |
0.40 |
0.25 |
|
漂白水重(g) |
2.1450 |
2.1425 |
2.1279 |
2.1353 |
2.1494 |
2.1312 |
2.1395 |
2.1545 |
2.1522 |
|
硫代硫酸鈉溶液 |
16.70 |
16.75 |
16.60 |
16.60 |
16.80 |
16.60 |
16.60 |
13.40 |
8.05 |
|
漂白水中有效氯 |
2.74 |
2.76 |
2.75 |
2.74 |
2.75 |
2.75 |
2.74 |
2.19 |
1.32 |
圖五:2.0 M硫酸用量與有效氯含量之實驗結果(橫軸為硫酸用量,縱軸為有效氯含量)
由圖五可知,添加的2 M硫酸用量從10.0 mL減少至0.50 mL時,測得漂白水之有效氯含量皆接近2.75%,若2 M硫酸用量降至0.40 mL以下,則會影響漂白水中有效氯含量分析的結果;推論實驗應需在適當酸性條件下反應,由實驗結果看來,我們發現硫酸用量0.50 mL就足以提供實驗所需酸性。透過平衡反應式[4],理論上,次氯酸鈉與硫酸的莫耳數比為1:2。實際上,次氯酸鈉計算的莫耳數為1.66 × 10–3莫耳(16.60 mL × 0.100 M),硫酸使用的莫耳數為2.0 × 10–3莫耳(1.0 mL × 2.0 M),得到次氯酸鈉與硫酸比為1.66:2.0,此比值高於1:2甚多,亦即硫酸為過量試劑,與理論相符合。
前述「實驗二」的實驗條件和結果是(一)固定使用5.0 mL的2.0 M碘化鉀溶液並且減少2 M硫酸溶液用量,則2 M硫酸用量可減少到0.50 mL;(二)固定使用5.0 mL的2.0 M 硫酸用量並且減少2.0 M碘化鉀溶液用量,2.0 M碘化鉀溶液用量可減少到1.0 mL。若此二小實驗合併條件,亦即使用量2.0 M硫酸0.50 mL和2.0 M碘化鉀溶液1.0 mL,則漂白水中有效氯含量之分析是否可行呢?今年三月間指導教師曾於繁忙課務與活動期間抽空試作此一實驗,結果發現我們設計實驗所測得之氯含量與利用標準方法所測得的結果相近,初步確認此實驗同時減少碘化鉀與硫酸的用量條件應為可行。而推測上述實驗條件之高可行性與分析待測樣品(市售漂白水)之純度多為5%以下有相當關係。若樣品濃度較高,則上述實驗條件是否可行可能需進一步研究。
n 參賽學生心得
非常感謝教育部提供這次的機會讓我們(第一和二作者)可以參與這次的專題製作比賽,也讓我們可以與全台高手交流。在製作專題的過程中,花費了我們四個月的時間來完成此作品,從蒐集資料、選擇題目、小組討論、實驗研究、術聚整理到報告撰寫,每一步都紮紮實實的完成。從7月到10月,我們為了完成這個專題而利用自己的暑假和平日的休假時間,希望可以將作品完整地呈現出來,在我們努力的研究與改進下,得到的實驗結果也達到了我們所期望藥品減量的目標與初衷。
決賽當天我們都非常的緊張,雖然老師已經帶我們提早去會場作好準備,但是看到其他組參賽同學堅定的眼神,還是會讓我們有些許畏懼,然而在老師的鼓勵與支持下,我們立即重拾自信。雖然之前就曾參加過一些專題演講的報告,可是在當天口頭報告時還是會緊張,怕自己腦袋空白而口誤,不過我們盡量克服緊張,彼此互相鼓勵,最後終能順利的完成競賽。
在得知自己與同伴們獲獎後,我們很感謝科上的老師能夠肯定我們,讓我們去參加這次的競賽,也很謝謝科內老師們的指導並替我們加油打氣,若沒有他們的鼓勵,我們也不會有機會為校爭光。
在花東地區,要做出一件科展作品其實是難上加難,由於資源的不足及有些器材缺乏的情況下,而導致無法擴大實驗範圍或是做不出來,因此為了讓視野更廣大,我們希望可以藉由一些專題製作比賽或是一些科展活動,可以讓我們到外縣市與其他人多交流觀摩,獲得更多知識及經驗。
最後,希望教育部能夠提供更多關於化學的專題製作比賽,讓那些喜愛動手作實驗的學生能夠有機會展現出他們努力的成品,彼此互相交流切磋而成長。
圖六:競賽頒獎現場,校長親臨道賀
n 結語
關於「漂白水中有效氯含量之測定」,我們發現如下:(一)標定硫代硫酸鈉標準溶液之實驗藥品用量減少:2 M硫酸用量可從5 mL減少至1 mL,相當於減少80%的用量而不影響實驗結果。(二)漂白水中有效氯含量實驗藥品用量減少之可行性研究:2 M碘化鉀用量可從5 mL減少至1 mL,相當於減少80%的用量而不影響實驗結果。2 M硫酸用量可從10 mL減少至0.5 mL,相當於減少95%的用量而不影響實驗結果。(三)此二小實驗合併條件(亦即使用量2.0 M硫酸0.50 mL和2.0 M碘化鉀溶液1.0 mL),結果發現測得的有效氯含量與標準結果相近,初步確認本實驗同時減少碘化鉀和硫酸的用量應為可行。
經過這次的比賽,讓我們學生知道其實化學這個領域是很有趣的,當你發現新結果或是完成一個艱鉅的實驗時,那種感覺是誰也無法體會的,唯獨自己親手下去做,了解整個實驗過程中的每一步,才會知道那些科學家是如此的偉大。
n 參考資料
1. 丙級化學學術科通關寶典(2014)。廖建治、蔡永昌。台科大圖書股份有限公司(新北市)。
2. 有效氯,百度百科(2014),http://baike.baidu.com/view/659742.htm。
3. 澱粉指示劑,化學資訊網站(2001),http://www.chemedu.ch.ntu.edu.tw/questions/answer60.htm。
4. Jiajhu's Blogger(2009)。化學丙級 101年術科練習題 第二站:980302-3漂白水中有效氯之測定,http://a2098101141.blogspot.tw/2012/08/101-980302-3.html。
5. 定量分析及實驗(1998)。林敬二、楊寶旺、陳寶山。高立圖書有限公司(台北市)。
6. 普通化學實驗II(2001)。楊永華。東大圖書公司(台北市)。
7. 分析化學實驗II(2008)。鄭新讚、鄭茜如。東大圖書公司(台北市)。
8. 分析化學實驗II(2002)。張國華、傅芳馨。全華科技圖書股份有限公(台北市)。
9. 化學實驗環境保護篇(2002)。廖明淵。新文京開發出版有限公司(台北縣)。



Please give us your valuable comment